Буферные растворы
Буферные растворы – это растворы, рН (концентрация ионов водорода) которых сохраняется практически постоянной при разбавлении или при добавлении небольших количеств серной кислоты или сильного основания.
Буферным действием обладают:
1)Система слабая кислота – её соль с сильным основанием, а также сочетание кислой и средней солей слабых кислот или двух кислых солей. Примеры:
| Система | Область буферного действия |
| СН3СООН/СН3СООNa | pH: 3,8-5,8 |
| H2CO3/NaHCO3 | pH: 5,4-7,4 |
| NaHCO3/Na2CO3 | pH: 9,3-11,3 |
| NaH2PO4/Na2HPO4 | pH: 6,2-8,2 |
2) Система слабое основание – его соль с сильной кислотой:
| NH3×H2O/NH4Cl | pH: 8,2-10,2 |
3) Ионы и молекулы амфолитов – аминокислотные и белковые системы.
Буферная емкость почв:
В почвах катионы водорода, приносимые дождевой водой или образующиеся в результате жизнедеятельности, вытисняют из твердой фазы Са2+. В результате почва приобретает определенную буферную емкость – при добавлении щелочных веществ ионы Н+, связанные с твердой фазой почвы, переходят в почвенный раствор, компенсируя потери этим раствором ионов Н+ при нейтрализации щелочами. Из кислых глинистых материалов наибольшей буферной емкостью обладают минералы, монтриллонит Na0,7(Al3,3Mg0,7)(Si8O20)×nH2O.
Буферная емкость океана:
Мировой океан обладает огромной буферной емкостью, потому, что он является открытой системой. Основная буферная реакция – равновесие при диссоциации угольной кислоты:
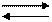 H2CO3 H++HCO
H2CO3 H++HCO 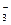 ,
,
При понижении кислотности происходит дополнительное поглощение углекислого газа из атмосферы с образованием кислоты:
 CO2+Н2О H2CO3 ,
CO2+Н2О H2CO3 ,
При повышении кислотности происходит дополнительное растворение карбонатных пород (раковины, меловые отложения в океане); этим компенсируется убыль гидрокарбонатных ионов:
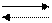 H2+CO
H2+CO 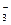 HCO
HCO 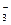 ,
,
 СаCO3 Са2++CO
СаCO3 Са2++CO 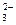 .
.
Твердые карбонаты переходят в растворимые гидрокарбонаты. Именно этот процесс химического растворения избыточного углекислого газа противодействует “парниковому эффекту” – глобальному потеплению из-за поглощения углекислым газом теплового излучения Земли.
Буферная емкость измеряется количеством кислоты или щелочи (моль или моль эквивалентов), добавление которого к 1л буферного раствора изменяет рН на единицу.
Механизм буферного действия хорошо описан в рекомендованной литературе [1], поэтому приведем только готовые формулы для расчета рН:
Для кислотного буфера рН=рKкисл + l g[соль]/[кислота], (11.13)
Для основного буфера рН=14-рKосн - lg[соль]/[основание], (11.14)
где pKкисл и рKосн – соответственно отрицательные десятичные логарифмы констант диссоциации слабой кислоты и слабого основания.
Кислотно – основными индикаторами называют вещества, меняющие свою окраску в определенной области рН раствора: лакмус (рН = 6-8), фенолфтаилин (рН = 8,2-10), метиловый оранжевый (рН = 4,2-6,3).
Вопросы для самоконтроля
1. С помощью каких веществ можно определить характер среды раствора?
2. Какие вещества называются индикаторами? Какие индикаторы вы знаете?
3. Какие реакции называются ионными реакциями?
4. Какими уравнениями выражаются ионные реакции?
5. Формулы каких веществ в ионных уравнениях записывают в виде молекул?
6. В каких случаях реакции обмена в растворах электролитов являются необратимыми?
7. В каких случаях реакции обмена в растворах электролитов являются обратимыми?
8. В каких случаях реакции обмена в растворах электролитов не протекают?
9. Какую реакцию среды показывают водные растворы различных солей? Почему?
10. Что называется гидролизом соли?
11. В чем сущность гидролиза солей?
12. Что называется степенью гидролиза и от чего она зависит?
13. Какие соли подвергаются гидролизу?
14. Какие соли гидролизуются по аниону? Почему? Приведите примеры таких солей.
15. Какие соли гидролизуются по катиону? Почему? Приведите примеры таких солей.
16. Какие соли гидролизуются и по катиону, и по аниону? Приведите примеры таких солей.
17. Какие соли не гидролизуются? Почему?
18. Какие соли гидролизуются ступенчато? Приведите примеры таких солей.
Дата добавления: 2015-08-08; просмотров: 1679;
