Расчет рН буферного раствора.
Константа диссоциации уксусной кислоты
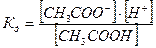
Концентрация не диссоциирующих молекул равна концентрации кислоты.
Концентрация [СН3СОО-] при диссоциации соли значительно больше концентрации диссоциирующих молекул, тогда
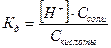 ;
; 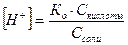
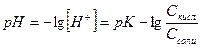 , где
, где  =
= 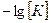
Таким образом рН является функцией соотношения кислоты и соли, при разбавлении соотношение 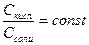 , поэтому при разбавлении рН буферного раствора постоянна.
, поэтому при разбавлении рН буферного раствора постоянна.
Для смеси слабых оснований и их солей
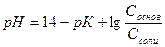
ПРИМЕР
Рассчитаем рН ацетатно-буферного раствора, в котором ссоли = скислоты= = 0,1
моль/л. В этом случае рН = рКд = 4,75. Если в этот раствор добавить НС1
концентрации 10-2 моль/л, то из-за реакции
Н+ + С1- + СНзСОО - = СНзСООН + С1-
концентрация соли уменьшится на 10 -2 моль/л, а концентрация кислоты
увеличится на 10-2 моль/л.

Как видно, рН изменилась незначительно (на 0,09 единицы).
Если бы это количество НС1 добавить в дистиллированную воду, то ее рН
изменилась бы от 7 до 2 (на 5 единиц).
Дата добавления: 2015-08-11; просмотров: 790;
