ГИДРОЛИЗ
Многие неорганические вещества, растворяясь в воде вступают с ней в химическую реакцию.
Обменная реакция между растворимым веществом и водой называется гидролизом.
Гидролизу подвергаются только растворимые соли, но не все.
Существует понятие сильной кислоты и сильного основания, т.е. те которые в воде диссоциируют полностью, например:
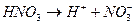
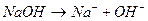
Слабая кислота
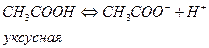
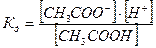
Слабое основание
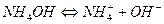
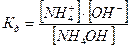
Соли, образованные сильной кислотой и сильным основанием не гидролизуются, их растворы нейтральны, рН = const при растворении = 7.
Соли, образованные катионом сильного основания и анионом слабой кислоты гидролизуются по аниону, например
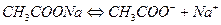
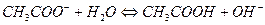
рН > 7, избыток ионов ОН-
Соли, образованные многоосновными слабыми кислотами и сильными основаниями гидролизуются ступенчато: например, Na2CO3
I ступень: 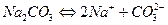
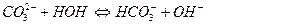
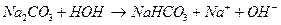

 II ступень:
II ступень: 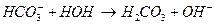
Н2О СО2 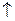
Гидролиз I ступени всегда преобладает.
Гидролиз обратим, эндотермичен (в этом случае).
Соли, образованные катионом слабого многоосновного основания и анионом сильной кислоты гидролизуются по катиону.
Например 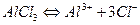
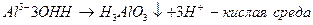
Гидролизу подвергаются соли, образованные катионом очень слабого основания и анионом очень слабой кислоты.

Гидролиз в данном случае необратим.
Соли, образованные катионом слабого основания и анионом слабой кислоты, например Cu (OOCCH3)2 гидролизуются по катиону и аниону.
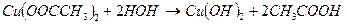
рН зависит от того, какой ион гидролизуется в большей степени, рН может быть как слабокислый, так и слабощелочной.
Дата добавления: 2015-08-11; просмотров: 1002;
