Глава 8. Термодинамика смесей идеальных газов.
8.1. Характеристические функции идеального газа.
Для адиабатического процесса в системе ( Q = 0) мы можем записать
ΔU = -A
Если идеальный газ расширяется адиабатически от объема V и температуры T до бесконечно большого объема, то он совершает работу
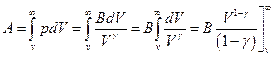
а поскольку 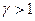 , то подстановка верхнего предела дает 0, подстановка нижнего приводит к
, то подстановка верхнего предела дает 0, подстановка нижнего приводит к 
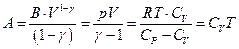
Следовательно 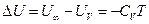
а поскольку 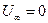 , то внутренняя энергия идеального газа, имеющего данную температуру, равна
, то внутренняя энергия идеального газа, имеющего данную температуру, равна
U = CVT
Очевидно, поскольку для идеального газа dU = CV dT, то по первому закону для идеального газа :
dQ = CVdT + pdV
Разделив правую и левую часть на Т, получим
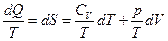
Интегрирование дает 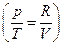
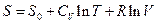
Константа интегрирования S0 не зависит ни от температуры, ни от давления или объема. Как мы увидим позднее для любого вещества в состоянии идеального газа в константу S0 в качестве характеристики вещества входит только его мольная масса.
Далее
H = U + pV = U + RT = CVT +RT = CpT
F = U – TS = CVT – TS0 - CVT ln T –RT ln V
G = H – TS = CpT – T( S0 + R ln R ) – CpT ln T + RT ln p
Легко видеть, что, вообще говоря,
F = F ( T ) – RT ln V
G = G (T ) + RT ln p
где F ( T ) и G ( T ) являются функциями только температуры.
8.2. Химический потенциал газа в смеси идеальных газов.
Смешение газов – самопроизвольный процесс, происходящий вследствие диффузии. Дальтон (1801) отметил, что если взятые газы имеют одинаковую температуру и давление, то в отсутствие химической реакции а) объем смеси равен сумме объемов составляющих газов в) температура остается постоянной в течение процесса. То-есть, если исходные объемы смешивающихся газов равны Vii ,то общий объем смеси равен 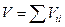 . Отметим, что Vii = ni Vi , где ni –число молей газа i, Vi – мольный объем его до процесса смешения. Поскольку давление р в процессе смешения не меняется, то для смеси
. Отметим, что Vii = ni Vi , где ni –число молей газа i, Vi – мольный объем его до процесса смешения. Поскольку давление р в процессе смешения не меняется, то для смеси 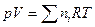 , а для i – газа, занимающего объем смеси V , парциальное давление pipi V = niRT, следовательно
, а для i – газа, занимающего объем смеси V , парциальное давление pipi V = niRT, следовательно 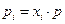 . Обозначим индексом i мольные свойства i – ого газа. Тогда для смеси газов
. Обозначим индексом i мольные свойства i – ого газа. Тогда для смеси газов
 и, следовательно,
и, следовательно,
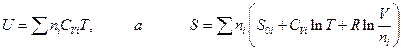
и энергия Гельмгольца смеси:
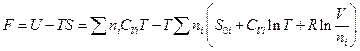
Теперь становится возможным вычислить химический потенциал i – ого газа:
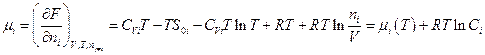
где 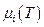 - функция только температуры, а
- функция только температуры, а 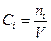 -концентрация i –ого газа. Поскольку для смеси
-концентрация i –ого газа. Поскольку для смеси 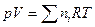 , то
, то
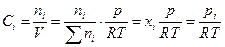
и химический потенциал i –ого газа можно выразить через другие величины
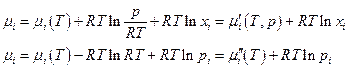
Очевидно, что μi(T) – химический потенциал газа, когда Ci = 1 ; μ' (T,p) – химический потенциал, когда xi = 1, т.е. это мольная энергия Гиббса чистого газа i; μ''(T) – химический потенциал i -ого газа при pi = 1.
8.3. Энтропия смешения.
Энтропия смеси газов равна (см.выше)
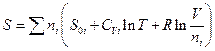
но 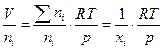
Поскольку газ i имел до смешения давление p и объем Vii = nVi , имеем

и энтропия смеси тогда:
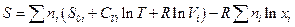
Полином в скобках представляет собой мольную энтропию газа i до процесса смешения, поэтому сумма есть не что иное как энтропия системы до процесса смешения, следовательно, изменение энтропии системы в результате смешения газов 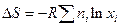 или в расчете на 1 моль смеси:
или в расчете на 1 моль смеси:
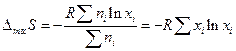
Поскольку 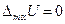 , то работа, которую можно получить в результате обратимого процесса смешения газов:
, то работа, которую можно получить в результате обратимого процесса смешения газов:
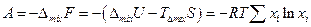
Очевидно, что для разделения смеси газов на компоненты нужно затратить работу
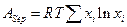
Однако это только теоретическая величина, практически затрачиваемая работа будет намного больше, причем чем меньше отличаются по свойствам компоненты, тем большая потребуется работа.
Например, разделение изотопов урана осуществляют, используя гексафторид урана. Природная смесь содержит 99,3 % U238 F6 и 0,7 % U235F6 . Так вот теоретически необходимо затратить 0,023 квт·час на выделение 1 кг U235F6, практически приходится затрачивать 1,2·106 квт·час или в 50·106 раз больше.
Мы видим также, что возрастание энтропии при смешении газов зависит только от количества молей этих газов, но не зависит от их природы. В предельном случае, когда смешивается один и тот же газ, разделенный сначала перегородкой на две части, увеличения энтропии не должно быть, так как в этом случае после удаления перегородки никакого термодинамического процесса в системе не происходит. Таким образом, смешение идентичных газов нельзя рассматривать как предельный случай смешения различных газов. Легко сообразить, что если смешиваемые газы имели до смешения одинаковое давление р, то после смешения они имеют парциальные давления pi <p, а если газы идентичны, то давление не меняется. При переходе от образования смеси сколь угодно близких (разделимых) газов к смеси одинаковых газов величина ΔmixS испытывает скачок. Это утверждение получило название парадокса Гиббса.
Дата добавления: 2015-07-30; просмотров: 2240;
