Уравнение Клапейрона – Клаузиуса
6.1. Определения.
Фазой называется совокупность частей системы, обладающих одинаковыми термодинамическими свойствами. Система, состоящая из одной фазы, называется гомогенной, из двух или более – гетерогенной. Фаза более общее понятие, чем индивидуальное вещество. Система может состоять из одного вещества, но быть гетерогенной (вещество находится в системе в виде разных агрегатных состояний или кристаллических модификаций). Система может быть гомогенной, но содержать несколько химических соединений, пример этого – растворы.
Назовем составляющими веществами системы такие химические соединения, которые могут быть выделены из системы и существовать отдельно от нее. Назовем независимыми компонентами такие составляющие вещества, концентрации которых могут изменяться независимо. Если в системе не протекают химические реакции, то все вещества, составляющие систему, являются независимыми компонентами.
Но в случае фактического протекания химических реакций концентрации только части веществ могут изменяться независимо, поэтому число независимых компонентов равно числу составляющих веществ минус число химических реакций, которые фактически протекают в систее.
6.2. Условия равновесия и направление самопроизвольного процесса в однокомпонентной гетерогенной системе.
Пусть гетерогенная однокомпонентная система имеет две фазы (΄) и (˝), а мольные энергии Гиббса компонента в каждой из фаз G΄ и G˝ соответственно. Пусть давление и температура постоянны, а изменение чисел молей компонента в фазе (´) равно 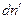 , в фазе (´)
, в фазе (´) 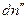 , тогда изменение энергии Гиббса системы равно:
, тогда изменение энергии Гиббса системы равно:
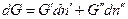
Если система закрытая, то 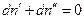 , и
, и
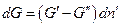
При равновесии 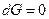 , а это возможно, когда
, а это возможно, когда
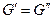
т.е при равновесии мольные энергии Гиббса компонента в фазах равны.
Самопроизвольный процесс в системе может протекать только в сторону уменьшения энергии Гиббса системы, т.е. 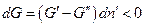 . Положим, для определенности, что
. Положим, для определенности, что 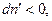 тогда
тогда 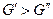 , если же
, если же
 Это значит, что компонент самопроизвольно переходит из той фазы, где его мольная энергия Гиббса больше, в ту фазу, где его мольная энергия Гиббса меньше.
Это значит, что компонент самопроизвольно переходит из той фазы, где его мольная энергия Гиббса больше, в ту фазу, где его мольная энергия Гиббса меньше.
Изменим давление и температуру на бесконечно малые величины dT и dp, тогда очевидно, что если система остается равновесной и гетерогенной
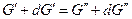
следовательно, и 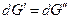 .
.
6.3. Уравнение Клапейрона-Клаузиуса.
Очевидно, что
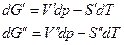
где V’,V’’,S’,S” мольные объемы и мольные энтропии компонента в фазах (‘) и (“). Из условий равновесия
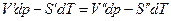 или
или
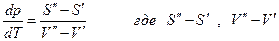 изменеие энтропии и объема при переходе 1 моля компонента из фазы ( ‘ ) в фазу ( “ ), т.е. это мольные изменения энтропии и объема фазового превращения.
изменеие энтропии и объема при переходе 1 моля компонента из фазы ( ‘ ) в фазу ( “ ), т.е. это мольные изменения энтропии и объема фазового превращения.
Учитывая, что фазовое превращение рассматривалось как равновесное и изотермическое, то
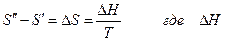 - теплота фазового превращения и окончательно
- теплота фазового превращения и окончательно
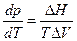 уравнение Клапейрона –Клаузиуса
уравнение Клапейрона –Клаузиуса
Заметим, что в уравнении Клапейрона ΔH и ΔVотносятся к одноименным процессам и на одно и тоже количество вещества.
6.4. Фазовое равновесие в конденсированных системах.
Конденсированной системой называется такая, в которой не имеется в наличии газообразная фаза, а только твердые или жидкие или те и другие вместе.
Наиболее интересным является равновесие кристалл ↔ жидкость. Поскольку теплота плавления всегда положительна, знак производной 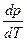
будет зависеть от знака ∆V. Для большинства веществ ∆V>0 (Vж > Vкр), и производная положительна, т.е. температура лавления будет расти с ростом давления. Однако у некоторых веществ (H2O, Ga, Bi, Sb, Ge, Si и др.) при плавлении происходит уменьшение объема, Vж < Vкр , и температура плавления понижается с повышением давления. Так для воды 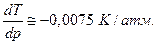
Если предположить, что для конденсированных систем ∆H и ∆V не зависят ни от давления, ни от температуры, то уравнение Клапейрона-Клаузиуса легко интегрируется 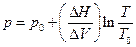
Интересным является рассмотрение равновесия
С (графит) →С (алмаз)
Использование справочных данных для энтальпий образования и энтропий графита и алмаза дает для этого превращения
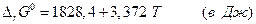
откуда видно, что при любых температурах 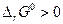 . Но поскольку
. Но поскольку
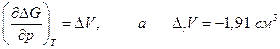
то с увеличением давления ∆rG должна уменьшаться и при данной температуре графит и алмаз находятся в равновесии, тогда когда ∆rG = 0. Предположив, что ∆V не зависит от давления, получим после интегрирования
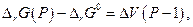 откуда
откуда
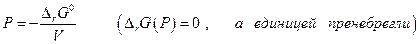
Подставив численные значения ∆rG0 и ∆V получим
Р (атм) = 9448 + 17,42 Т
При 300 К Р=14670 атм
1000 К Р=26870 атм
1500 К Р=35580 атм ,
т.е. равновесные давления имеют порядок десятков тысяч атм.
Далее
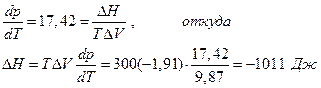
и мы видим, что при высоком давлении поменялся даже знак теплового эффекта. Действительно, возьмем уравнение Гиббса-Гельмгольца
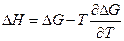 и возьмем производную по давлению :
и возьмем производную по давлению :
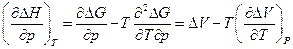
после интегрирования и ряда упрощений имеем
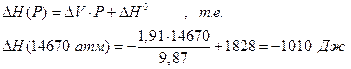
6.5. Интегрирование уравнения Клапейрона-Клаузиуса для процесса парообразования.
Переход жидкости в пар называют испарением, обратный процесс
конденсацией. Испарение твердых тел называют возгонкой или сублимацией, обратный – кристаллизацией. Пар, который находится в равновесии с конденсированной фазой, называется насыщенным паром.
Поскольку теплота парообразования положительна, а мольный объем пара больше мольного объема конденсированной фазы, это значит, что производная в уравнении Клапейрона-Клаузиуса
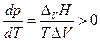
т.е. с ростом температуры давление насыщенного пара увеличивается.
При температурах, далеких от критических, мольный объем пара много больше мольного объема конденсированной фазы, поэтому последним можно пренебречь, а если в этой области температур насыщенный пар подчиняется уравнению состояния идеального газа, то
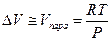
и уравнение Клапейрона-Клаузиуса можно представить в виде
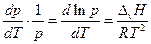
В нешироком интервале температур теплоту испарения можно считать постоянной и взятие определенного интеграла дает:
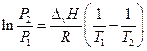
Таким образом, если известна ∆v H, то, зная давление насыщенного пара вещества при одной температуре, можно рассчитать давление насыщенного пара при другой температуре. С другой стороны, определив давление насыщенного пара при двух (по крайней мере) температурах, можно рассчитать теплоту испарения.
Взятие неопределенного интеграла дает (при ∆v H = const)
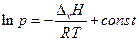 или
или
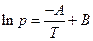
где А и В – константы, характерные для данного вещества. Это уравнение, линейное в координатах ln p – 1/T, дает прямую линию в значительном интервале температур. Более точным является уравнение Антуана
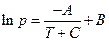 где А, В, С – константы.
где А, В, С – константы.
Практически полезным может оказаться правило Трутона: энтропия испарения вещества в нормальной точке кипения (при 1 атм.) равна приблизительно 90 Дж/моль.К. Тогда в уравнение Клапейрона-Клаузиуса входит только одна константа Тнтк – температура нормальной точки кипения:
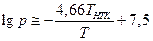
По этому уравнению удобно рассчитывать температуру перегонки органических соединений под пониженным давлением. Однако следует отметить, что правило Трутона соблюдается только для «нормальных» жидкостей, т.е. таких молекулы которых не ассоциированы в жидкой фазе (как у воды за счет водородных связей), а также если пары не состоят из полимерных или диссоциированных молекул.
Для уксусной кислоты прямые определения теплоты испарения в калориметре при температуре кипения СН3СООН равной 391 К дает величину 406Дж/г. С другой стороны при 363 К давление пара 293 торр, при 391 К 760 торр. Заменив производную в уравнении Клапейрона-Клаузиуса отношением конечных приращений имеем
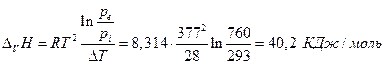
Мольная масса СН3СООН равна 60, тогда из калориметрических данных

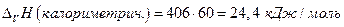
Расхождение между этими двумя значениями связано с тем, что для получения одного моля пара необходимо испарить больше, чем 60 г СН3СООН, следовательно мольная масса пара СН3СООН равна
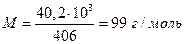
отсюда легко сообразить, что пары уксусной кислоты в этом температурном интервале димеризованы примерно на 2/3.
Насыщенный пар обладает еще рядом интересных свойств. Рассмотрим некоторые из них.
Пусть в гетерогенной системе при температуре Т находится 1 моль вещества, причем в равновесии находятся m молей пара и 1-m молей жидкой фазы. Пусть теплоемкость пара Сп, жидкости Сж, изменяем температуру от Т до T+dT, при этом испаряется масса жидкости dm, тогда затраты тепла dQ можно представить в виде соотношения:
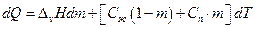
Разделим правую и левую части на Т, имеем
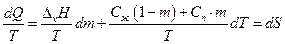
следовательно, справедливо:
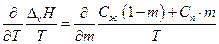
после дифференцирования имеем
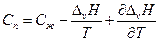
По уравнению Кирхгоффа
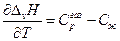 и
и
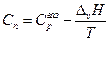
т.е. теплоемкость насыщенного пара не равна изобарной теплоемкости того же газообразного вещества.
Следует также иметь в виду, что введение постороннего (инертного) газа изменяет давление насыщенного пара при неизменной температуре, даже если газ не растворяется в жидкости. Это происходит вследствие влияния общего давления на свойства конденсированной фазы (возрастает ее мольная энергия Гиббса). Действительно, при T=const
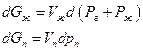
где Рг – давление постороннего газа, Рж давление насыщенного пара, Vж и Vп -мольныеобъемы жидкости и пара. Поскольку по условию равновесия dGж =dGп
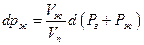
Взятие интеграла от Рг = 0 до Рг приводит к уравнению
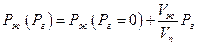
Поскольку дробь Vж/Vn невелика (для воды при 373 К она равна 5,9∙10-4), то влияние постороннего газа сказывается только при высоких давлениях.
Например, для воды под давлением водорода при 373 К
| ||||||
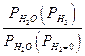
| эксп | 1,018 | 1,19 | 1,66 | 2,35 | |
| расч | 1,015 | 1,12 | 1,35 | 1,802 |
Глава 7. Термодинамические свойства многокомпонентных систем. Растворы. Химический потенциал.
7.1. Определения.
Раствором называется гомогенная, молекулярно-дисперсная система, состав которой можно изменять непрерывно в некотором конечном или бесконечном интервале.
По агрегатному состоянию растворы разделяются на тврдые, жидкие и газообразные. Если растворитель и растворенное вещество имеют разные агрегатные состояния, то растворителем рассматривают обычно то вещество, агрегатное состояние которого совпадает с агрегатным состоянием раствора. Если же компоненты раствора и раствор имеют одинаковое агрегатное состояние, то за растворитель считают то вещество, которого больше, хотя для термодинамики это безразлично.
Состав раствора измеряется его концентрацией. Существуют следующие основные определения концентрации:
мольная доля ( х ) – число молей вещества в 1 моле раствора;
моляльность ( m ) – число молей растворенного вещества в 1000 г растворителя;
молярность ( с ) – число молей растворенного вещества в 1 л раствора;
массовое содержание ( р ) – число грамм растворенного вещества в 100 г раствора.
В основном мы будем пользоваться мольной долей. Очевидно, что
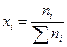 , а
, а 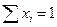
Если М0 и М мольные массы растворителя и растворенного вещества, а d – плотность раствора, г/см3, то переход от одной концентрации к другой можно представить следующими формулами (раствор, естественно, бинарный):
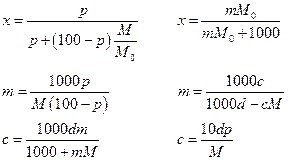
7.2. Характеристические функции многокомпонентных систем.
Первый и второй законы термодинамики, из которых следуют фундаментальные уравнения, были получены для закрытых систем, т.е. систем, процессы в которых не приводят к изменению количества компонентов. Реально же чаще встречаются системы, в которых при различных процессах изменяются количества компонентов. Это может происходить, скажем, при фазовых превращениях или вследствие протекания химической реакции. При этом может изменяться состав как отдельных частей, так и системы в целом.
Поэтому внутренняя энергия (и другие функции состояния) открытых систем будут изменяться не только за счет сообщения системе теплоты и произведенной системой работы, но и за счет изменения состава системы. Следовательно для открытых систем характеристические функции будут функциями не только их двух естественных переменных, но и функциями числа молей всех веществ , составляющих систему:
U = U ( S, v, n1……………….nk )
H = H ( S, p, n1 ………….. nk )
F = F ( T, v, n1…………… nk )
G = G ( T, p, n1……………nk )
Дата добавления: 2015-07-30; просмотров: 2024;
