Задача 5. Для реакции CO(г) + Cl2(г) ⇄ COCl2(г) вычислить константу равновесия Кр, используя табличные значения термодинамических функций при стандартных
Для реакции CO(г) + Cl2(г) ⇄ COCl2(г) вычислить константу равновесия Кр, используя табличные значения термодинамических функций при стандартных условиях. По значению величины Кр ответить на вопрос: исходные вещества или продукты реакции преобладают в равновесной смеси?
Решение. Константа равновесия реакции связана со стандартным изменением свободной энергии Гиббса соотношением DG0х.р. = - 2,303RT lgKp (1). В свою очередь, DG0х.р. (химической реакции) можно рассчитать по изменению стандартных величин энтальпии и энтропии в ходе этой реакции DG0х.р. = DН0х.р. - Т∙DS0х.р. ∙10-3 (2). Значения DН0х.р. и DS0х.р. вычисляют по первому следствию из закона Гесса, используя табличные значения стандартных энтальпий образования и энтропий веществ DН0х.р. = å(DН0298)кон - å(DН0298)исх и DS0х.р. = å(DS0298)кон - å(DS0298)исх. Значения DН0298 и S0298 веществ, участвующих в реакции приведены в таблице.
| Вещество | DН0298, кДж/моль | S0298, Дж/моль∙К |
| CO (г) | -110,6 | 197,7 |
| Cl2(г) | 222,9 | |
| COCl 2 (г) | -220,3 | 283,9 |
DН0х.р. = DН0298 (COCl2) - DН0298(Cl2) - DН0298(CO) =
-220,3 – 0 – (-110,6) = -109,7кДж
DS0хр= S0298(COCl2) - S0298(Cl2) - S0298(CO) = 283,9 – 222,9 – 197,7 = -136,7 Дж/К
DG0хр = -109,7 – 298 ∙(-136,7)∙10-3 = -69,3 кДж
Из уравнения (1) следует
lgKp= 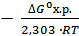 = -
= - 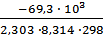 = 12,13 Кр= 1012,13, т.к. Кр>>1, то при Т=298К в равновесной смеси будут преобладать продукты реакции.
= 12,13 Кр= 1012,13, т.к. Кр>>1, то при Т=298К в равновесной смеси будут преобладать продукты реакции.
Дата добавления: 2015-07-24; просмотров: 7778;
