Задача 3. При 5000С равновесие реакции N2(г) + 3H2(г) ⇄ 2NH3(г) установилось при следующих концентрациях (моль/л) реагентов: [N2] = 1,8; [H2] = 7,4; [NH3] = 0,4
При 5000С равновесие реакции N2(г) + 3H2(г) ⇄ 2NH3(г) установилось при следующих концентрациях (моль/л) реагентов: [N2] = 1,8; [H2] = 7,4; [NH3] = 0,4. Определить: а) исходные концентрации азота и водорода; б) давление в реакционном сосуде в начальный момент и в момент наступления равновесия.
Решение. Обозначим исходные концентрации веществ как [N2]исх, [H2]исх. Часть исходных веществ, прореагировавших к моменту наступления равновесия как [N2]изр, [H2]изр, а равновесные концентрации как [N2]равн, [H2]равн, [NH3]равн. В начальный момент времени в реакционной смеси присутствуют только азот и водород в начальных концентрациях. В процессе реакции их концентрации убывают, а концентрация аммиака увеличивается. После установления равновесия (когда скорости прямой и обратной реакций равны) в равновесной смеси присутствуют не успевшие прореагировать азот и водород и успевший
образоваться аммиак, таким образом равновесные концентрации исходных веществ будут равны разности между их исходными концентрациями и тем количеством, которое прореагировало к моменту равновесия
[N2]равн = [N2]исх - [N2]изр; [H2]равн = [H2]исх - [H2]изр. Равновесные концентрации всех веществ даны в условии задачи, остается определить количества азота и водорода прореагировавших к моменту равновесия. Из уравнения реакции следует, что на каждые 2 моля образовавшегося аммиака затрачивается 1 моль азота и три моля водорода. По условию задачи к моменту равновесия успело образоваться 0,4 моля аммиака. Для этого потребовалось:
из 3 молей [H2] образуется 2 моля [NH3], а
из Х молей [H2] образуется 0,4 моля [NH3],
откуда Х = 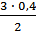 = 0,6 моля = [H2]изр.
= 0,6 моля = [H2]изр.
Аналогично находим, что к моменту равновесия израсходовалось [N2]изр = 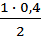 = 0,2 моля.
= 0,2 моля.
Рассчитаем исходные концентрации веществ
[N2]исх = [N2]равн + [N2]изр = 1,8 + 0,2 = 2,0 моль/л; [H2]исх = [H2]равн + [H2]изр = 7,4 + 0,6 = 8,0 моль/л.
Для решения этой задачи удобно составить схему:
N2(г) + 3H2(г) ⇄ 2 NH3 (г)
Сисх 2,0 8,0 0
Сизр 0,2 0,6 0
Сравн 1,8 7,4 0,4
С помощью этой схемы можно сделать любые расчеты, учитывая условия задачи.
б) Согласно условию, Т = 500 + 273 = 773К, V= 1л. Исходное число молей реагентов nнач = nнач [N2] + nнач[H2] = 2 + 8 = 10 молей. В состоянии равновесия число молей газов будет равно nравн = nравн [H2] + nравн[N2] + nравн [NH3] = 7,4 + 1,8 + 0,4 = 9,6 моль.
Подставляя полученные значения в уравнение ( P = CRT) рассчитаем давление газовой смеси в начальный момент и в момент равновесия (R=8,31Дж/моль∙К=0,082 л∙атм/моль∙град).
Рнач = 10∙0,082∙773 = 633,86 атм
Рравн = 9,6∙0,082∙773 = 608,5 атм
Очевидно, что давление к моменту равновесия уменьшилось, т.к. реакция идет с убылью числа молей газов.
Дата добавления: 2015-07-24; просмотров: 1523;
