ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Химические реакции принято подразделять на обратимые и необратимые. Необратимые химические реакции протекают до полного расходования хотя бы одного из исходных веществ, т.е. продукты реакции или совсем не вступают во взаимодействие друг с другом, или образуют вещества, отличные от исходных. Таких реакций очень мало. Например:
2KСlO3 (тв) = 2KCl (тв) + 3О2(г)
В растворах электролитов практически необратимыми считаются реакции, идущие с образованием осадков, газов и слабых электролитов (вода, комплексные соединения).
Большинство химических реакций являются обратимыми, т.е. они идут как в прямом, так и в обратном направлении. Это становится возможным, когда энергии активации прямого и обратного процессов отличаются друг от друга незначительно, а продукты реакции способны превращаться в исходные вещества. Например, реакция синтеза HI является типично обратимой реакцией:
H2(г) + I2(г) ⇄ 2HI(г)
Закон действующих масс (выражение скорости реакции) для прямого и обратного процессов соответственно будет иметь вид: 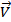 =
= 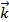 [H2] ∙ [I2];
[H2] ∙ [I2]; 
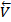 =
= 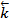 [HI]2
[HI]2
В какой-то момент времени наступает состояние, когда скорости прямой и обратной реакций становятся равными 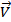 =
= 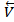 (рис.4).
(рис.4).
| V |
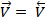
|
| t |
|
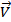
|
Рис.4 Изменение скоростей прямой ( 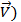 и обратной (
и обратной ( 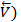 реакций с течением времени t
реакций с течением времени t
Это состояние называется химическим равновесием. Оно носит динамический (подвижный) характер и может сдвигаться в ту или другую сторону в зависимости от изменения внешних условий. Начиная с момента равновесия, при неизменных внешних условиях концентрации исходных веществ и продуктов реакции не изменяются с течением времени. Концентрации реагентов, отвечающие состоянию равновесия, называются равновесными. Для определения равновесной концентрации реагента необходимо из его начальной концентрации вычесть количество вещества, прореагировавшего к моменту наступления равновесного состояния: Сравн. = Сисх. – Спрореагир. Количество реагентов, вступивших в реакцию и образовавшихся из них к моменту равновесия продуктов, пропорциональны стехиометрическим коэффициентам в уравнении реакции.
Состояние равновесия при неизменных внешних условиях может существовать сколь угодно долго. В состоянии равновесия
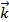 [H2] ∙ [I2] =
[H2] ∙ [I2] = 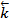 [[HI]2, откуда
[[HI]2, откуда 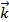 /
/ 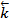 [= [HI]2/[H2] ∙ [I2] .
[= [HI]2/[H2] ∙ [I2] .
При постоянной температуре константы скоростей прямого и обратного процесса являются величинами постоянными.
Отношение двух констант является также величиной постоянной K = 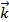 /
/ 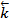 и носит название константа химического равновесия. Она может быть выражена
и носит название константа химического равновесия. Она может быть выражена
либо через концентрации реагентов 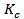 =
= 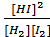 , либо через их парциальные давления
, либо через их парциальные давления 
 ,если реакция протекает с участием газов.
,если реакция протекает с участием газов.
В общем случае для реакции aA + bB + … ⇄ cC + dD + … константа химического равновесия равна отношению произведения концентраций продуктов реакции к произведению концентраций исходных веществ в степенях, равных их стехиометрическим коэффициентам.
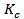 =
= 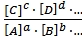
Константа химического равновесия не зависит от пути протекания процесса и определяет глубину его протекания к моменту достижения равновесного состояния. Чем больше эта величина, тем больше степень превращения реагентов в продукты.
Константа химического равновесия, также как и константы скоростей реакций, являются функциями только температуры и природы реагирующих веществ и не зависят от их концентрации.
Для гетерогенных процессов концентрация твердых веществ в выражение скорости реакции и константы химического равновесия не включается, т.к. реакция протекает на поверхности твердой фазы, концентрация которой остается во времени постоянной. Например, для реакции:
FeO(тв) + CO(г) ⇄ Fe(тв) + CO2(г)
выражение константы равновесия будет иметь вид:
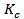 =
= 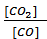 ,
, 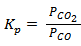
Кр и Кс связаны соотношением Kp = Kc(RT)∆n, где Dn = ånпрод. - ånисх.веществ – изменение числа молей газообразных веществ в ходе реакции. Для данной реакции Кр = Кс, т.к. Dn газообразных веществ равно нулю.
Дата добавления: 2015-07-24; просмотров: 1447;
