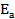ВЛИЯНИЕ КАТАЛИЗАТОРОВ НА СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Катализаторами называют вещества, способные ускорять химическую реакцию, при этом сами катализаторы в химической реакции не расходуются. Установлено, что катализаторы изменяют механизм химической реакции. При этом возникают другие, новые переходные состояния, характеризуемые меньшей высотой энергетического барьера. Таким образом, под действием катализатора снижается
энергия активации процесса (рис.3). Вступая в различного рода взаимодействия с промежуточными частицами, катализаторы по окончании реакции остаются в неизменном количестве. Катализаторы оказывают действие только на термодинамически разрешенные реакции. Катализатор не может вызвать реакцию, т.к. не влияет на ее движущие силы. Катализатор не влияет на константу химического равновесия, т.к. в равной степени уменьшает энергию активации и прямой, и обратной реакций.
Рис.3 Энергетическая диаграмма хода реакции А + В = АВ а) без катализатора и б) в присутствии катализатора. Еа - энергия активации некаталитической реакции; Еа1 и Еа2 - энергия активации каталитической реакции; АК – промежуточное реакционноспособное соединение катализатора с одним из реагентов; А…К, АК…В – активированные комплексы каталитической реакции; А…В - активированный комплекс некаталитической реакции; ∆Екат. – снижение энергии активации под влиянием катализатора.
Различают гомогенный и гетерогенный катализ. В первом случае катализатор находится в одной фазе с реагентами, а во втором - катализатором является твердое вещество, на поверхности которого идет химическая реакция между реагентами.
Дата добавления: 2015-07-24; просмотров: 1669;