Адсорбционное равновесие
Вещество в конденсированном состоянии обладает поверхностной энергией, обусловленной нескомпенсированностью полей частиц на поверхности раздела фаз.
Термин «поверхностная энергия» применяется к границе раздела газ – твердое тело, жидкость – твердое тело.
Под поверхностной энергией понимается энергия Гиббса образования поверхности. Она равна произведению удельной поверхностной энергии d на площадь поверхности раздела фаз:
DG=d ∙ S , (9.9)
Для неассоциированных жидкостей удельная поверхностная энергия зависит от температуры:
d=d0-a(Т-Т0) , (9.10)
где d0 – поверхностное натяжение при Т0 = 273 К;
a = 0,1 мДж/м2 ∙ к.
Адсорбция – изменение концентрации вещества на границе раздела фаз; адсорбция представляет собой процесс поглощения газов, паров или жидкостей поверхностью пористых твердых тел. Процесс адсорбции является избирательным и обратимым.
Адсорбент – вещество, способное адсорбировать другое вещество.
Адсорбтив – вещество, которое может адсорбироваться.
Адсорбат – адсорбированное вещество.
Количественной мерой адсорбции является избыток адсорбированного вещества Г, равный разности концентраций вещества в поверхностном слое и в объеме раствора, (моль/м2; моль/см2).
Адсорбцию подразделяют на:
а) физическую – вандерваальсовы силы взаимодействия, невысокий тепловой эффект;
б) хемосорбцию – возникают химические связи, значительный тепловой эффект.
Адсорбция протекает самопроизвольно - энергия Гиббса адсорбции имеет отрицательное значение: DGадс<0.
Тепловой эффект имеет отрицательное значение DНадс<0.
Адсорбция – процесс избирательного поглощения компонента из газа или пара с помощью жидких поглощений. В тоже время в процессе адсорбции происходит упорядочения адсорбированных частиц: DSадс<0.
C увеличением температуры энергия Гиббса системы возрастает, при некоторой Тр наступает равновесие:
адсорбция

 А Аадс .
А Аадс .
десорбция
9.5.1 Адсорбция на границе раздела газ – твердое тело.
Изотерма адсорбции - зависимость избытка адсорбированного вещества от равновесной концентрации Ср или равновесного давления при постоянной температуре.
|
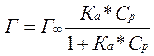 |
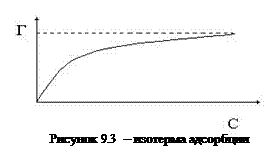
Уравнение Лэнгмюра и Фрейдлиха:
где Г¥ - адсорбция при максимальном значении;
Ср – равновесная концентрация адсорбата;
Ка – константа равновесия процесса адсорбции.
Другое уравнение изотермы адсорбции – эмпирическое уравнение Фрейдлиха:
Г=Кф ∙ рn , (9.12)
где Кф, n – постоянные;
р - равновесное давление адсорбата.
Адсорбция зависит от природы адсорбента и адсорбата. Наиболее распространенные адсорбенты: активированные угли. Хорошо адсорбируют малополярные газы и пары гидрофильный адсорбент - силикагель. Другие адсорбенты: цеолиты, алюмосиликатные пористые вещества.
10.5.2 Адсорбция на границе раздела твердое тело – жидкость.
Удельная адсорбция ( а, моль/кг) молекул из раствора:
|
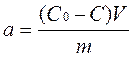 |
где С0 и С – концентрации адсорбата а растворе до и после адсорбации;
V – объем раствора;
m – масса адсорбента.
Правило выравнивания полярностей (М.А. Ребиндер) – на полярных адсорбентах лучше всего адсорбируются полярные адсорбаты из неполярных растворителей, а на неполярных – неполярные адсорбаты из полимерных растворителей.
Уравнение Лэнгмюра и Фрейдлиха:
а = Кф∙ С n, (9.15)
где Кф и n – постоянные.
На явлении адсорбции основаны способы очистки газов и жидкостей от различных примесей, при подготовке питьевой воды, при осушке газов, при получении чистых веществ. В медицине адсорбционные методы используются для извлечения вредных веществ из крови.
Вопросы для самоконтроля
1. Как формулируется закон действующих масс?
2. Чему равна константа скорости реакции?
3. Что называется скоростью гомогенной реакции?
4. Какие реакции называются необратимыми? Приведите примеры.
5. Какие реакции называются обратимыми? Приведите примеры.
6. Что называется химическим равновесием?
7. Что называется константой равновесия?
8. От чего зависит и от чего не зависит константа равновесия?
9. Что характеризует численное значение константы равновесия?
10. Как формулируется принцип подвижного равновесия Ле-Шателье?
11. Какие внешние факторы влияют на смещение химического равновесия?
12. Как влияет изменение концентрации реагирующих веществ на состояние химического равновесия? Приведите примеры.
13. Как влияет температура на состояние химического равновесия? Приведите примеры.
14. Как влияет давление на состояние химического равновесия? В каких случаях давление не влияет на химическое равновесие? Приведите примеры.
15. Приведите примеры фазового равновесия.
16. Какое число степеней свободы имеет однофазная система, состоящая из твердого и жидкого СО2?
17. Что такое тройная точка?
18. Определите скорость реакции А+В = АВ при концентрациях: са= 2 моль/л; св= 0,5 моль/л и константе скорости реакции 10–3 моль –1 · л · с –1.
19. Константы скоростей прямой и обратной реакций при 298 К равны соответнно 10–5с–1 и 10–9с–1. Рассчитайте стандартную энергию Гиббса реакции.
20. Может ли при обычных условиях протекать реакция
½ N2 + ½ O2 = NO
Известно, что в верхних слоях атмосферы образуется оксид азота NO. Как вы можете объяснить образование NO?
21. При сгорании ацетилена развивается очень высокая температура, что обусловлено высокой теплотой сгорания ацетилена. На этом основана ацетилено-кислородная сварка черных металлов. Рассчитайте стандартную теплоту и удельную теплоту сгорания ацетилена.
Дата добавления: 2015-08-08; просмотров: 4045;
