Химическое равновесие в гетерогенных системах
Химические реакции, протекающие на границе раздела фаз, называются гетерогенными химическими реакциями. Если скорости прямой и обратной гетерогенных реакций равны, то наступает гетерогенное химическое равновесие:
 С(к) + 2Н2О СО2 + 2Н2 , (а)
С(к) + 2Н2О СО2 + 2Н2 , (а)
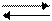 МО(к) + Н2 М(к) + Н2О, (б)
МО(к) + Н2 М(к) + Н2О, (б)
 СаСО3 СаО(к)+СО2 . (в)
СаСО3 СаО(к)+СО2 . (в)
Условие гетерогенного химического равновесия – равенство нулю изменения энергии Гиббса:
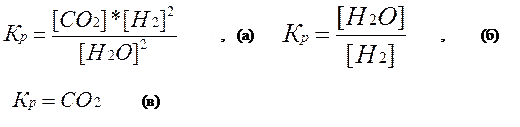 |
Константы гетерогенного химического равновесия, приведенных выше химических реакций:
|
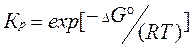 |
В уравнения констант гетерогенного химического равновесия не входят никакие члены, относящиеся к твердым веществам, участвующим в прямой и обратной реакциях.
Константа гетерогенного химического равновесия зависит от температуры, при повышении температуры:
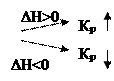 |
t
Твердые исходные вещества и продукты реакции не влияют на смещение гетерогенного химического равновесия.
9.4 Фазовое равновесие
Равновесие, при котором происходят процессы перехода вещества из одной фазы в другую без изменения химического состава, называетсяфазовым равновесием:
плавление
 Твердое вещество жидкость
Твердое вещество жидкость
кристаллизация
испарение
 Жидкость пар
Жидкость пар
конденсация
Условием фазового равновесия является равенство энергии Гиббса нулю DG=0.
Для фазового равновесия соблюдается принцип Ле Шателье.
Выбор параметров, влияющих на равновесие данной гетерогенной системы и условием равновесия определяется ПРАВИЛОМ ФАЗ. Это наиболее общий закон гетерогенного химического и фазового равновесия. Правило фаз Гиббса – Коновалова:
Число степеней свободы в гетерогенной системе равно числу компонентов, плюс число внешних условий и минус число фаз:
С = К + 2 — Ф, (9.8)
где С – число степеней свободы;
К – число компонентов;
Ф – число фаз.
Компонентом называется химически однородная составная часть вещества, которая может быть выделена из системы.
В случае фазового равновесия число независимых компонентов равно общему числу компонентов.
Например: смесь О2 и N2 – двухкомпонентная.
При протекании химических реакций число независимых компонентов равно общему числу компонентов за вычетом числа химических реакций, связывающих эти компоненты.
СО2+С=2СО к=3 – 1 = 2
Числом степеней свободы С называется число внешних условий, которые можно изменить в определенных пределах без изменения числа и вида фаз.
На фазовое равновесие влияют t, p, то n=2, тогда: С=к+2-Ф.
Фазовая диаграмма (диаграмма состояния) -диаграмма, по которой можно определить условия устойчивости фаз и фазового равновесия.
Для однокомпонентных систем:
С = 3 - Ф .
Однофазовые системы имеют две степени свободы и называются бивариантными.
Двухфазовые системы имеют одну степень свободы и называются моновариантной.
Трехфазовая система не имеет степеней свободы (С=0) и называются инвариантной.
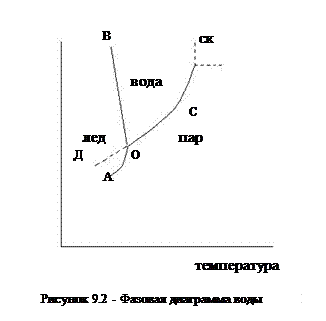
Фазовая диаграмма воды (рисунок 10.2):
ОС – равновесие процесса кипения;
точка «С» - критическая точка; выше точки «С» - сверхкритическое состояние: низкая вязкость, высокая диффузионная активность.
ОВ – кривая плавления;
ОА – процесс сублимации;
ОД – метастабильное состояние (переохлаждение);
точка О – тройная точка, существует равновесие между тремя фазами.
Дата добавления: 2015-08-08; просмотров: 1808;
