Уравнение Аррениуса
С. Аррениус предложил полутеоретический метод оценки влияния температуры на константу скорости химической реакции, который впоследствии получил дополнительное обоснование.
Идея метода Аррениуса заключается в следующем.
Предположим, что протекает обратимая реакция:
k1
A D B.
k −1
Константа равновесия этой реакции равна:
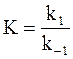 . (11 - 3)
. (11 - 3)
Зависимость константы равновесия от температуры определяется уравнением изобары Вант-Гоффа:
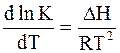 . (11 - 4)
. (11 - 4)
Гипотеза Аррениуса утверждает, что тепловой эффект реакции DH можно представить в виде разности двух величин:
DH = E1 – E −1, (11 - 5)
причем E1 относится к прямой реакции, а E−1 - к обратной.
С учетом равенств (11 - 3) и (11 - 5) уравнение (11 - 4) можно записать в следующей форме:
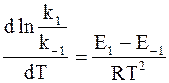
или
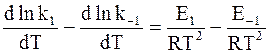 . (11 - 6)
. (11 - 6)
Так как прямая и обратная реакции принимаются независимыми друг от друга, то уравнение (11 - 6) можно рассматривать как разность двух независимых уравнений. Первое из них содержит k1 и E1, а второе - k−1 и E−1:
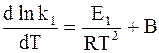 ;
;
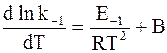 .
.
Аррениус предположил в согласии с экспериментальными данными, что постоянная В, появляющаяся при разделении уравнения (11 - 6) на составляющие части, равна 0. С учетом этого для любой частной реакции можно записать обобщенную форму уравнения:
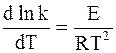 . (11 - 7)
. (11 - 7)
Уравнение (11 - 7) называется дифференциальной формой уравнения Аррениуса. Входящая в него величина Е, имеющая размерность Дж/моль, называется энергией активации.
Интегрирование уравнения (11 - 7) дает:
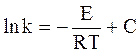 , (11 - 8)
, (11 - 8)
где С - постоянная интегрирования.
Обозначив eC = k0, окончательно имеем:
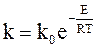 . (11 - 9)
. (11 - 9)
Уравнение (11 - 9) называется уравнением Аррениуса.
При выводе уравнения Аррениуса, кроме использования нескольких произвольных допущений, предполагалось, что тепловой эффект реакции не зависит от температуры. Такое предположение возможно для сравнительно узкого температурного интервала. В связи с этим интервал температур, в котором можно определять энергию активации, также должен иметь ограничения.
Для графического определения энергии активации по экспериментальным данным используют в качестве координат обратную температуру и логарифм константы скорости (рис. 11 ‑ 1). Тангенс угла наклона прямой в этих координатах равен отношению энергии активации к универсальной газовой постоянной.
| Рис. 11 - 1. Графическое определение энергии активации. |
Следует отметить, что подобный характер зависимости от температуры имеют и другие кинетические величины: коэффициент диффузии, текучесть (величина, обратная вязкости). Энергию активации диффузии и вязкого течения также находят по углу наклона прямой в координатах: обратная температура, логарифм кинетической величины. Эти координаты называются координатами Аррениуса.
Представляет интерес зависимость между температурным коэффициентом реакции g и энергией активации Е. Для этого воспользуемся уравнениями (11 - 1) и (11 ‑ 9).
Подстановка констант kT и kT+10, которым соответствует температура Т и Т+10, в уравнение (11 - 9) с учетом уравнения (11 - 1) дает:
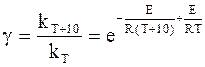
или, принимая, что T>>10, получим,
 , (11 - 10)
, (11 - 10)
а также
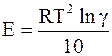 . (11 - 11)
. (11 - 11)
Эмпирическое правило Вант-Гоффа показывает, что для реакций, протекающих при температуре, близкой к комнатной (Т » 300 К), энергия активации находится в пределах 20¸40 кДж/моль.
Дата добавления: 2015-07-22; просмотров: 2922;
