Эмпирические закономерности влияния температуры на скорость реакций
В результате длительного периода развития химических наук было установлено, что с повышением температуры скорость химических реакций возрастает. Поэтому для ускорения химических превращений химики в первую очередь стремились повысить температуру среды, в которой протекает реакция.
Обобщая обширный экспериментальный материал, Вант-Гофф пришел к выводу, что зависимость константы скорости реакции от температуры может быть представлена в виде сравнительно простой закономерности:
При повышении температуры на 10 К константа скорости реакции увеличивается в 2 ¸ 4 раза (эмпирическое правило Вант-Гоффа).
Отношение константы скорости реакции при температуре, повышенной на 10 К, к константе скорости при исходной температуре называется температурным коэффициентом константы скорости.
В связи с этим может применяться другая формулировка эмпирического правила Вант-Гоффа:
температурные коэффициенты констант скоростей реакций g находятся в пределах от 2 до 4:
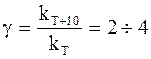 . (11 - 1)
. (11 - 1)
В соответствии с эмпирическим правилом Вант-Гоффа константу скорости при температуре, превышающей исходную на DТ, можно рассчитать по формуле:
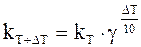 . (11 - 2)
. (11 - 2)
Хотя эмпирическое правило Вант-Гоффа не имеет теоретического обоснования, в ряде случаев оно оказывается полезным для ориентировочных расчетов. В частности, оно используется для оценки скорости процесса в сложных системах. В качестве примера использования эмпирического правила Вант-Гоффа можно привести решение проблемы оценки скорости деградации веществ в почве в различных климатических условиях и в разные времена года.
Дата добавления: 2015-07-22; просмотров: 824;
