Теория активных столкновений
Теория активных столкновений (она также называется теорией активных соударений) явилась первой теорией, количественно объяснившей данные кинетических исследований на основе молекулярно-кинетических представлений. Эта теория разработана как для случая бимолекулярных столкновений, так и для тримолекулярных столкновений. Ниже рассматриваются основные результаты, полученные для бимолекулярных столкновений.
В основе теории использованы следующие предположения (постулаты теории активных соударений):
1) Первым актом возможного взаимодействия молекул является их столкновение.
2) Столкновение молекул может служить причиной превращения молекул только в том случае, если энергия столкновения превышает или по крайней мере равна некоторой критической величине eа. Столкновения с энергией, равной этой величине или превышающей ее, называются активными.
3) Активные столкновения приводят к благоприятному исходу, то есть к началу химической реакции, если расположение молекул в момент столкновения соответствует данной реакции.
Первый постулат теории означает, что теория не рассматривает реакции, протекающие под непрерывным воздействием квантов света или частиц высокой энергии (гамма-квантов, электронов и т.д.).
Второй постулат теории предполагает, что для начала химического превращения сталкивающиеся молекулы должны обладать энергией, достаточной для преодоления вполне определенного энергетического барьера. Если энергия столкновения молекул оказывается меньше eа, то происходит упругий удар без каких-либо химических превращений.
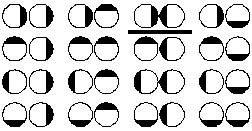 Рис. 12 - 1. Условное представление положений молекул в момент столкновения.
Рис. 12 - 1. Условное представление положений молекул в момент столкновения.
|
Из третьего постулата следует, что не все активные столкновения эффективны. На рис. 12 - 1 условно показаны возможные положения двух молекул в момент столкновения. Условные благоприятные для реакции положения на рисунке подчеркнуты. Отношение числа положений, благоприятствующих химической реакции, к общему числу возможных положений молекул в момент столкновения называется стерическим фактором. Расчеты показывают, что обычно величина стерического фактора близка к 10−2.
Молекулярно-кинетическая теория дает возможность рассчитывать число столкновений с определенной энергией.
Общее число столкновений Z0 в единичном объеме газовой фазы определяется уравнением:
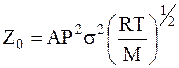 , (12 - 1)
, (12 - 1)
в котором A - числовой коэффициент, P - давление, s - эффективный диаметр столкновения, M - эффективная молярная масса сталкивающихся молекул.
Объединив все характеристики сталкивающихся молекул с числовым коэффициентом в единую константу для данной реакции b, уравнение (12 - 1) можно записать в следующей форме:
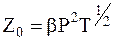 . (12 - 2)
. (12 - 2)
Число столкновений с энергией ei подчиняется распределению Больцмана:
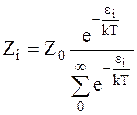 . (12 - 3)
. (12 - 3)
Число активных столкновений в единичном объеме представляет собой сумму всех столкновений, энергия которых не меньше eа: _______________________ 
или
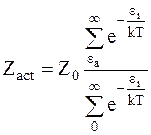 . (12 - 4)
. (12 - 4)
Число первичных химических превращений за единицу времени в единичном объеме в соответствии с третьим постулатом теории окажется равным:
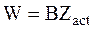 , (12 - 5)
, (12 - 5)
а с учетом уравнений (12 - 2) и (12 - 4):
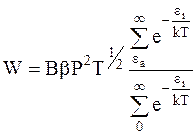 . (12 - 6)
. (12 - 6)
Для бимолекулярной реакции в газовой фазе зависимость скорости от давления выражается уравнением:
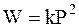 . (12 - 7)
. (12 - 7)
Сравнивая уравнения (12 - 6) и (12 - 7), получим уравнение для константы скорости реакции:
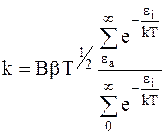 . (12 - 8)
. (12 - 8)
Прологарифмируем уравнение (12 - 8):
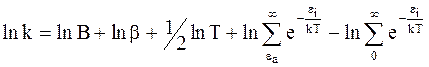
и продифференцируем по температуре:
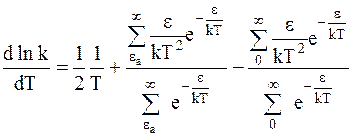 . (12 - 9)
. (12 - 9)
Пренебрегая в первом приближении величиной 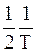 и проведя преобразования, получим:
и проведя преобразования, получим:
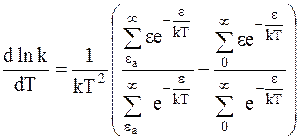 . (12 - 10)
. (12 - 10)
Для выяснения смысла отношений сумм, заключенных в скобках в правой части уравнения (12 - 10), отметим, что энергия всех активных соударений Xact равна:
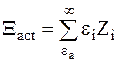 . (12 - 11)
. (12 - 11)
С учетом уравнения (12 - 3) равенство (12 - 11) приобретает следующий вид:
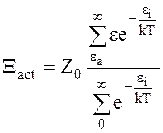 . (12 - 12)
. (12 - 12)
Отношение полной энергии активных столкновений к числу всех активных столкновений представляет собой среднюю энергию активного столкновения:
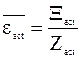 . (12 - 13)
. (12 - 13)
Сравнение уравнений (12 - 4), (12 - 12) и (12 - 13) показывает, что первое отношение сумм в уравнении (12 - 10) представляет собой среднюю энергию активного соударения:
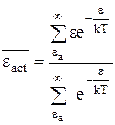 . (12 - 14)
. (12 - 14)
Второе отношение сумм представляет среднюю энергию всех столкновений в системе:
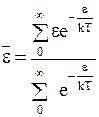 . (12 - 15)
. (12 - 15)
Равенства (12 - 14) и (12 - 15) позволяют представить уравнение (12 - 10) следующим образом:
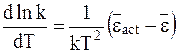 . (12 - 16)
. (12 - 16)
Умножение числителя и знаменателя правой части уравнения (12 - 16) на постоянную Авогадро дает:
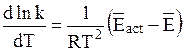 , (12 - 17)
, (12 - 17)
где 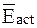 и
и 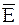 - соответственно средняя энергия 1 моль активных соударений и средняя энергия 1 моль всех соударений.
- соответственно средняя энергия 1 моль активных соударений и средняя энергия 1 моль всех соударений.
Сравнение уравнения Аррениуса в дифференциальной форме (11 - 7) и уравнения (12 - 17) позволяет установить, чем же в соответствии с теорией активных соударений является энергия активации.
Энергия активации равна разности средней энергии 1 моль активных соударений и средней энергии 1 моль всех соударений:
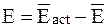 . (12 - 18)
. (12 - 18)
Напомним, что уравнение (12 - 18) имеет приближенный характер, так как при его выводе была исключена производная 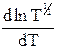 . Уточненное значение энергии активации EA со значением величины E выражается соотношением:
. Уточненное значение энергии активации EA со значением величины E выражается соотношением:

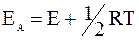 . (12 - 19)
. (12 - 19)
Иная трактовка энергии активации дается теорией активированного комплекса, которая будет рассмотрена в дальнейшем.
Дата добавления: 2015-07-22; просмотров: 1091;
