Теория переходного состояния (теория активного комплекса)
В основе теории переходного состояния используются следующие положения (постулаты теории).
1) Столкновение частиц приводит к образованию связи между ними.
Неустойчивое состояние, в котором существуют связи между всеми частицами, называется переходным состоянием. Его также представляют как комплекс, временно образуемый взаимодействующими частицами, и называют активным комплексом.
Образование и распад активного комплекса происходит только в одном направлении (см. рис. 12 - 3).
2) Порядок образования и распада комплекса таков. Взаимодействующие частицы движутся друг к другу до тех пор, пока между ними не возникнет дополнительная связь, образование которой приводит к ослаблению связи, уже существующей в одной из взаимодействующих молекул. Затем частицы начинают расходиться. Ослабленная ранее существовавшая связь исчезает, а возникшая при сближении частиц новая связь остается.
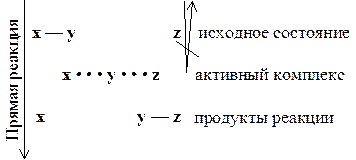 Рис. 12 - 3. Образование и распад активного комплекса.
Рис. 12 - 3. Образование и распад активного комплекса.
|
Данный постулат запрещает распад активного комплекса на исходные частицы. Он может распадаться только с образованием продуктов реакции.
3) Образование активного комплекса не приводит к нарушению распределения частиц по скоростям и энергиям Максвелла - Больцмана.
4) Предполагается, что смещение электронных орбиталей в частицах при образовании активного комплекса происходит во много раз быстрее, чем движение атомных ядер.
Этот постулат теории переходного состояния называется принципом адиабатности. Он лежит в основе расчетов энергии взаимодействующих частиц, так как предполагает, что электроны всегда успевают принять наиболее устойчивую конфигурацию для задаваемого расстояния между центрами атомов.
Покажем, как могут быть использованы вышеприведенные постулаты для вывода основного уравнения теории переходного состояния.
Пусть протекает, как показано на рис. 12 - 3, реакция:
XY + Z = X + YZ .
Формально скорость этой реакции определяется уравнением:
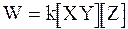 . (12 - 26)
. (12 - 26)
С другой стороны, скорость образования продуктов реакции определяется числом распадающихся в единицу времени активных комплексов по схеме:
kA.C.
X××× Y×××Z ¾® X + YZ.
Так как распад комплекса является мономолекулярной реакцией, то для ее скорости можно записать следующее выражение:
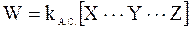 . (12 - 27)
. (12 - 27)
Используя уравнение (9 - 20), связывающее константу скорости необратимой реакции первого порядка со средним временем жизни превращаемого вещества 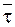 , равенство (12 - 27) можно представить следующим образом:
, равенство (12 - 27) можно представить следующим образом:
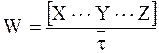 . (12 - 28)
. (12 - 28)
Сравнивая равенства (12 - 26) и (12 - 28), получим:
 . (12 - 29)
. (12 - 29)
Уравнение (12 - 29) является основным уравнением для расчета константы скорости реакции. Однако оно может получить окончательную форму, если выразить входящие в него величины через энергетические характеристики.
Среднее время жизни комплекса можно оценить, используя второй постулат теории.
Так как образование и распад комплекса происходят только в одном направлении, то его существование можно представить в виде одного колебательного цикла по новой связи. Энергия таких колебаний равна:
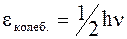 , (12 - 30)
, (12 - 30)
где h - постоянная Планка.
Энергия, необходимая для возбуждения колебаний, равна кинетической составляющей сталкивающихся частиц. При движении частиц вдоль одной оси она равна:
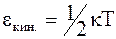 , (12 - 31)
, (12 - 31)
где k - постоянная Больцмана.
Из равенства кинетической энергии и энергии колебаний следует:
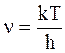 . (12 - 32)
. (12 - 32)
Частота колебаний представляет собой величину, обратную периоду одного колебания, а принимая во внимание, что комплекс существует только в течение одного колебательного цикла, имеем:
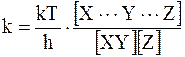 . (12 - 33)
. (12 - 33)
При сохранении равновесного распределения скоростей и энергий частиц соотношение между концентрациями исходных веществ и активного комплекса определяется константой K#:
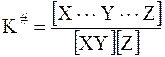 . (12 - 34)
. (12 - 34)
Константа К# не является истинной константой равновесия, так как комплекс не распадается в обратном направлении (на исходные частицы). Однако соотношение между концентрациями зависит от энергии частиц в исходном состоянии и в состоянии активного комплекса. В этом случае можно воспользоваться уравнением изотермы химической реакции в следующей форме (см. часть I, стр. 77):
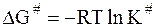 . (12 - 35)
. (12 - 35)
Изменение энергии Гиббса для перехода из исходного состояния частиц в состояние активного комплекса (переходное состояние) DG# определяется изменением энтальпии DH# и изменением энтропии DS#:
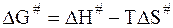 .
.
Следовательно, константа К# может быть представлена следующим образом:

или
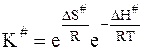 . (12 - 36)
. (12 - 36)
Таким образом, уравнение для константы скорости реакции приобретает вид:
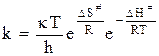 . (12 - 37)
. (12 - 37)
Величина 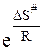 , содержащая энтропию активации DS#, соответствует стерическому множителю В теории активных столкновений. Энтальпия активации DH# в теории переходного состояния соответствует энергии активации. Для ее расчета необходимо знать энергию системы в исходном состоянии и энергию активированного комплекса.
, содержащая энтропию активации DS#, соответствует стерическому множителю В теории активных столкновений. Энтальпия активации DH# в теории переходного состояния соответствует энергии активации. Для ее расчета необходимо знать энергию системы в исходном состоянии и энергию активированного комплекса.
Для расчета изменения энергии системы при переходе из исходного состояния в переходное необходимо найти зависимость энергии системы от расстояний между атомами. В рассматривавшемся случае образования активного комплекса из исходной молекулы XY и частицы Z независимыми переменными служат расстояния между центрами атомов в паре X и Y, которые обозначим rXY, и расстояние между центрами атомов Y и Z, которое обозначим rYZ. Энергия системы является функцией этих переменных:
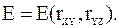
В системе трех координат эта зависимость передается поверхностью. Для представления зависимости энергии от расстояний rXY и rYZ на плоскости используется такой же метод, что и при построении топографических карт, а именно: проводятся равноотстоящие друг от друга плоскости, перпендикулярные оси энергии, а линии пересечения этих плоскостей с поверхностью наносятся на плоскость чертежа. На рис. 12 - 4 показан пример построения энергетической диаграммы по этому методу.
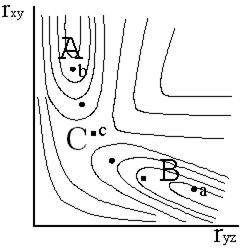 Рис. 12 - 4. Энергетическая диаграмма трехатомной системы.
Рис. 12 - 4. Энергетическая диаграмма трехатомной системы.
|
Для построения диаграммы рассчитывают потенциальную энергию системы для различных сочетаний расстояний rXY и rYZ. При этом используется четвертый постулат теории (принцип адиабатности), в соответствии с которым расчеты проводятся для систем с равновесными электронными конфигурациями. Молекула XY имеет минимум энергии при расстоянии между атомами, равном длине связи. Увеличение или уменьшение этого расстояния приводит к возрастанию энергии в отдельной молекуле. То же относится и к молекуле YZ. Следовательно, на диаграмме должны быть две области с пониженными значениями энергии А и В (их образно называют долинами). Области А и В отделены друг от друга участком небольшого подъема энергии С (его образно называют перевалом).
На типичной энергетической диаграмме (рис. 12 - 4) имеется несколько особых точек. Первая из них a отвечает исходному состоянию системы (состоянию до начала реакции). В этом состоянии расстояние между центрами атомов X и Y должно быть равно нормальной длине связи в устойчивом состоянии молекулы XY. Расстояние между центрами атомов Y и Z должно быть очень большим, так как частица Z еще не вступила во взаимодействие с молекулой XY. Еще одна характерная точка b отражает конечное состояние системы (состояние после реакции). Ей соответствует расстояние между центрами атомов Y и Z, равное длине связи во вновь образовавшейся молекуле, и большое расстояние между отделившейся частицей X и атомом Y. Третьей важнейшей точкой на энергетической диаграмме является точка перевала с. Именно в точке перевала существует полностью сформировавшийся активный комплекс.
Из изложенного следует, что химическое превращение согласно теории переходного состояния представляет собой переход из точки а в точку b через точку с. Такой переход происходит при минимальных значениях энергии (на энергетической диаграмме ему соответствует движение из точки а по дну долины А до перевала с, а затем спуск в долину В и движение до точки b). Он называется путем реакциии показан пунктирной линией.
Если разрезать пространственную энергетическую диаграмму по пути реакции перпендикулярно плоскости rXY - rYZ, то в разрезе получится линия, длина которой соответствует длине пути реакции, а ордината - энергии системы. Назовем линию в этих координатах профилем пути реакции(рис. 12 - 5).
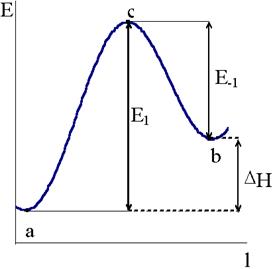 Рис. 12 - 5. Энергетический профиль пути реакции.
Рис. 12 - 5. Энергетический профиль пути реакции.
|
Разность между энергией системы в переходном состоянии и энергией в исходном состоянии Е1, как показано на рис. 12 - 5, представляет собой классическую энергию активации прямой реакции. Разность энергий в состоянии активного комплекса и конечном состоянии Е−1, равна энергии активации обратной реакции. Разность между энергиями активации прямой и обратной реакций соответствует тепловому эффекту реакции DН.
Таким образом, энергия активации в теории переходного состояния имеет четкую трактовку как величина энергетического барьера, равная разности энергий в переходном и исходном состояниях.
Как уже неоднократно отмечалось, все расчеты потенциальной энергии системы возможны лишь в том случае, когда электроны имеют равновесные конфигурации. В ходе реакции принцип адиабатности нарушается. Поэтому расчетное значение энергии оказывается завышенным. Для учета расхождения между расчетными и реальными значениями энергии в состоянии активного комплекса вводится поправочный коэффициент, который называется трансмиссионным коэффициентомc. С введением этой поправки основное уравнение теории переходного состояния принимает окончательный вид:
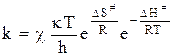 . (12 - 38)
. (12 - 38)
Теория переходного состояния применима не только к химическим превращениям, но и к другим кинетическим процессам: диффузии, вязкому течению, электрической проводимости растворов. Предполагается, что движение частиц в жидкости связано с преодолением энергетического барьера, величина которого равна энергии активации.
Дата добавления: 2015-07-22; просмотров: 2497;
