Основные законы фотохимии
Первый закон фотохимиибыл сформулирован в первой трети XIX в. в работах Х. Гроттуса (Россия), Дж. Дрейпера (США) и Дж. Гершеля (Великобритания). Его можно выразить следующим образом:
Фотохимическую реакцию вызывает та часть спектра света, которая поглощается веществом.
Для ориентировки в области видимого спектра (диапазон длин волн 400 - 700 нм) целесообразно знать приблизительные значения длин волн спектральных линий:
красный цвет - 640 нм,
оранжевый цвет - 600 нм,
желтый цвет - 580 нм,
зеленый цвет - 520 нм,
голубой цвет - 480 нм,
синий цвет - 470 нм,
фиолетовый цвет - 460 нм.
Опыт показывает, что водный раствор синего красителя обесцвечивается при интенсивном облучении его светом, дополнительным к синему, то есть оранжевым. Реакции фотосинтеза в растениях, протекающие в присутствии зеленого пигмента - хлорофилла, возбуждаются красным светом. Максимумы поглощения света хлорофиллом составляют 695 и 670 нм, что соответствует красной области спектра.
Химическое действие света количественно оценивается либо по количеству получаемого продукта реакции, либо по количеству расходуемых исходных веществ. Например, обесцвечивание красителя в водном растворе можно оценивать по уменьшению его концентрации. Обычно концентрацию вещества в фотохимической реакции, протекающей в растворе, оценивают фотометрически, используя закон Ламберта - Бугера - Бера, в соответствии с которым выполняется уравнение:
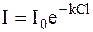 , (14 - 1)
, (14 - 1)
в котором I - интенсивность входящего в систему света, I0 - интенсивность света, выходящего из системы, k - константа, характерная для данного вещества и называемая коэффициентом поглощения, С - концентрация вещества, l - длина пути света в системе.
Интенсивность поглощения света представляет собой разность I0 − I. Эта же величина прямо пропорциональна поглощенной световой энергии.
Детально техника проведения фотометрических измерений описана в практикумах.
Второй закон фотохимиивпервые был сформулированР. Бунзеном и Г. Роско. Их редакцию можно представить следующим образом:
Химическое действие света прямо пропорционально произведению интенсивности поглощаемого света на время экспозиции.
Я. Вант-Гофф уточнил формулировку второго закона фотохимии, предложив следующую редакцию:
Химическое действие света прямо пропорционально поглощенной световой энергии.
Для измерения поглощаемой световой энергии используются специальные приборы, называемые актинометрами. Одна из конструкций актинометра содержит корпус с зачерненной полостью, в которую через щель направляется световой поток. Количественно поглощенная энергия оценивается по повышению температуры корпуса.
Третий закон фотохимиибыл сформулирован на основе квантовой теории Планка - Эйнштейна в 1912 г. Он называется также законом квантовой эквивалентности Эйнштейна - Штаркаи утверждает:
Каждый поглощенный квант световой энергии вызывает одну первичную фотохимическую реакцию.
Следует отметить, что понятия «первичная фотохимическая реакция» и «превращение молекулы в продукты реакции» не совпадают. Первичной фотохимической реакцией может оказаться переход молекулы в возбужденное состояние, которое, как уже было показано ранее, не всегда приводит к дальнейшему превращению, так как возбужденная частица, сталкиваясь с другими частицами или молекулами, может отдать избыточную энергию и вернуться в исходное состояние.
Число поглощаемых квантов световой энергии рассчитывают, исходя из следующих соображений.
Пусть поглощенная световая энергия (ее величину устанавливают экспериментально актинометрическими измерениями) равна Е, а длина волны поглощаемого светового излучения равна l. Энергия одного кванта равна:
e = hn.
Выразив частоту через длину волны l и скорость света с в виде 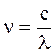 , получим:
, получим:
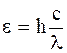 .
.
Число поглощенных квантов составит:
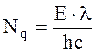 . (14 - 2)
. (14 - 2)
Число прореагировавших в фотохимической реакции молекул Nm определяют соответствующим химико-аналитическим методом.
Отношение числа прореагировавших молекул или числа молекул, образовавшихся в результате фотохимической реакции, к числу поглощенных квантов световой энергии называется квантовым выходом:
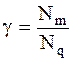 . (14 - 3)
. (14 - 3)
Опыт показывает, что квантовый выход находится в очень широких пределах. Для некоторых реакций он оказывается меньше 10−7, для других достигает 107. Например, фотодеградация красителей, нанесенных на ткани или пленки, имеет квантовый выход около 10−7, их разрушение в растворах сопровождается квантовым выходом около 10−4 ¸ 10−3. Квантовый выход реакции в газовой фазе между хлором и водородом приближается к 107. Для некоторых газовых реакций квантовый выход зависит от геометрических размеров сосуда, в котором протекает реакция.
Дата добавления: 2015-07-22; просмотров: 1314;
