Параллельные реакции
Рассмотрим наиболее простой случай параллельных реакций:
k1 k2
С ¾¾ A ¾¾® B.
Скорость реакции образования вещества В в соответствии с принципом независимого протекания реакций определяется уравнением:
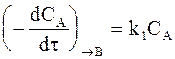 , (10 - 1)
, (10 - 1)
а скорость образования вещества С - уравнением:
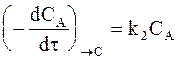 . (10 - 2)
. (10 - 2)
Общая скорость расходования вещества А по обеим реакциям составляет
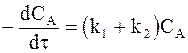 . (10 - 3)
. (10 - 3)
Интегрирование уравнения (10 - 3) с учетом граничных условий (СA = CA,0 при t = 0) дает:
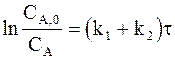 . (10 - 5)
. (10 - 5)
Другая форма уравнения для кинетики параллельных реакций первого порядка имеет следующий вид:
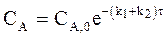 . (10 - 6)
. (10 - 6)
Из соотношений (10 - 1) и (10 - 2) следует, что отношение скоростей образования веществ В и С всегда постоянно и равно отношению констант скоростей k1 и k2. Следовательно, выполняется условие: отношение концентраций веществ В и С также равно отношению констант:
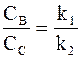 . (10 - 7)
. (10 - 7)
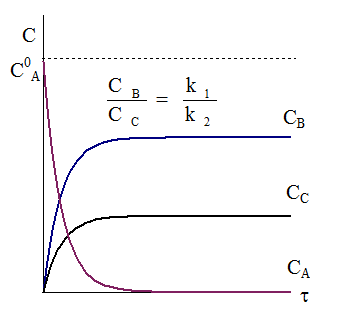 Рис. 10 - 1. Кинетические кривые для параллельных реакций первого порядка.
Рис. 10 - 1. Кинетические кривые для параллельных реакций первого порядка.
|
Из условия материального баланса
СВ + СС = СА,0 − СА
и соотношения (10 ‑ 7) следует:
 ,
, 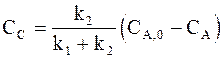 ,
,
а с учетом уравнения (10 ‑ 6) получим:
 ,
,
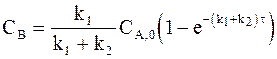 . (10 - 9)
. (10 - 9)
Типичный вид кинетических кривых и соотношение между концентрациями продуктов реакции и исходного вещества показаны на рис. 10 - 1.
Дата добавления: 2015-07-22; просмотров: 1128;
