СПОСОБЫ ДЕЗОБЛИТЕРАЦИИ СОСУДОВ
Восстановление проходимости окклюзированного сегмента сосуда — дезоблитерацию — в зависимости от причины закупорки и степени изменения сосудистой стенки осуществляют двумя основными способами: с сохранением целостности внутренней оболочки (эмбол- и тромбэктомия) или когда вместе с тромбом удаляют также измененную интиму, а нередко и часть медии (тромбэндартери-эктомия).
Эмболэктомия и тромбэктомия. Различают два способа эмболэктомии — прямой и непрямой (рис. 8).
При прямой эмболэктомии артерию выделяют и вскрывают в месте локализации эмбола.
Операция впервые выполнена И. Ф. Сабанеевым в 1895 г. безуспешно (больная умерла) и французом Labey в 1911 г.— успешно. Необходимым условием применения прямого способа является определение точной локализации эмбола по клиническим или ангиографическим данным.
Прямой метод эмболэктомии показан при расположении эмбола в легко доступных участках периферических артерий (бедренной, подмышечной, плечевой), наличии признаков патологических изменений сосудистой стенки вследствие атеросклероза, а также при поздних сроках после возникновения тромбоза, воспалении и сращении тромба со стенкой сосуда.
Техника операции состоит в следующем. Выделяют артерию в месте расположения эмбола. Нецелесообразно пользоваться сосудистыми зажимами для пережатия сосудов (их берут на резиновые держалки) при наличии продолженного тромба, чтобы не вызвать раздавливания и фрагментации его. Артериотомию производят над эмболом или несколько дистальнее его.
Мы предпочитаем поперечную или косую артериотомию. Продольное рассечение используем на артериях крупного калибра, при патологических изменениях стенки сосуда, учитывая возможность применения тромбэндартериэктомии.
Эмбол удаляют с помощью пинцета, сосудистого шпателя, способом «выдаивания» скользящими движениями, сдавливая артерию между I и II пальцами (рис. 9, а, б). Если эмбол не спаян с интимой, он выталкивается («рождается») струей крови (рис. 9, б).
При непрямойэмболэктомии артерию в месте расположения эмбола не выделяют, а удаляют эмбол и тромб через легко доступные для выделения периферические сосуды с помощью специальных инструментов и технических приемов.
Артериотомию производят про-ксимальнее (ретроградное удаление места окклюзии, нередко на значительном от него расстоянии.
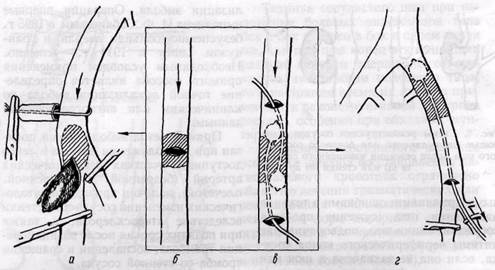
Рис. 8. Схема прямой (а, 6) и непрямой (в, г) эмболэктомии; в — ортоградная и ретроградная непрямая эмболэктомия с помощью баллонного катетера (стрелкой указано направление кровотока)
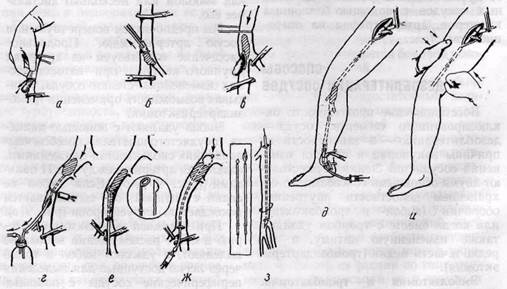
Рис. 9. Схема методов эмболэктомии. Удаление эмбола:
а — методом «выдаивания»;
б — пинцетом;
в — струей крови;
г — с помощью вакуум-отсоса;
д — ретроградное промывание артерии жидкостью под давлением;
е — кольцом Вольмара или интимо-тромбэкстрактором Шалимова;
ж - баллонным катетером;
s — катетером Дормиа;
и — методом компрессии эмбола) или дистальнее (ортоградная непрямая эмболэктомия)
Первая попытка ретроградного удаления эмбола из аорты через бедренную артерию с помощью плетеного катетера принадлежит Р. Р. Вредену (1897). Handley (1907) с этой целью применил методику отсасывания с помощью катетера, Key (1936) — кюретки, Griffiths (1938) — изогнутой по типу штопора металлической проволоки, Willman и Han Ion (1959) — вакуум-экстракцию (рис. 9, г) через стеклянную трубочку или пластмассовый катетер, введенные в артерию. Lerman и соавторы (1930), Olwin и соавторы (1953) и другие применяли методику ретроградного вымывания тромбов между двумя артериотомиями (рис. 9, d), Vollmar и Erich (1963) — специальный инструмент с кольцом («ringstripper», рис. 9, е), Fogarty и соавторы (1963) — баллонные катетеры (рис. 9, ж), Wandt (1973) — петлю для удаления камней мочевого пузыря (рис. 9, з). В отдельных случаях может быть использован прием компрессии по ходу сосудистого пучка (рис. 9, и).
В последние годы непрямая тромб-эмболэктомия приобрела ведущее значение. Необходимым условием для ее выполнения является наличие специальных инструментов, а также отсутствие атеросклеротических изменений сосудистой стенки и выраженной спаянности эмбола с интимой.
Наиболее широко в настоящее время применяют для удаления тромбов и эмболов баллонные катетеры. В 1963 г. американские хирурги (Fogarty и др.) предложили для ретроградной эмболэктомии катетер длиной до 80 см с надувным резиновым баллоном на верхушке. В Советском Союзе баллонные зонды для удаления эмболов и тромбов разработаны Ленинградским производственным объединением «Север» совместно с научно-исследовательским Институтом клинической и экспериментальной хи-
рургии МЗ СССР. Они бывают различного диаметра (№ 1—6) и по своим рабочим характеристикам не уступают лучшим зарубежным образцам.
После артериотомии легко доступного для выделения участка артерии проводят зонд за пределы эмбола между ним и стенкой сосуда или через массу тромба. Затем баллон заполняют раствором натрия хлорида и обратной тракцией зонд извлекают вместе с тромбом. Эту процедуру повторяют несколько раз до полного освобождения просвета сосуда.
Применение зонда Fogarty оказалось эффективным для удаления эмболов и тромбов из аорты, периферических артерий и крупных вен.
Наибольшие затруднения во время операции эмболэктомии могут возникнуть при удалении продолженного тромба и других «этажных» эмболов из дистального сосудистого русла, особенно при операциях в поздние сроки с момента возникновения эмболии. Операция не может считаться успешной, пока не будет достигнуто полное освобождение сосудов от тромбов (В. С. Савельев, И. И. Затевахин, 1970; Crawford, De Bakey, 1956).
Наиболее эффективно для этой цели использование баллонных катетеров Fogarty. У некоторых больных эффективным оказывается метод ретроградного промывания между двумя артериотомиями. Сущность последнего состоит в том, что теплый физиологический раствор с гепарином вводят под давлением ретроградно после артериотомии в дистальных отделах сосуда.
Менее эффективным является метод вакуум-экстракции. При отсасывании катетер соответствующего диаметра, срезанный под прямым углом, вводят в артерию до тех пор, пока он не встретит препятствия. Затем его соединяют с вакуум-отсосом или с хорошо пригнанным шприцем. Создавая отрицательное давление до 1 атм, осторожно производят обратную тракцию катетера и удаляют тромб.

Рис. 10.Схема тромбэктомии из дистально-го сосудистого русла с помощью модифицированного катетера с двумя баллончиками (1 и 2)
Если не удается извлечь тромбы из сосудов голени с помощью обычного баллонного катетера, мы применяем модифицированный нами (совместно с А. С. Мазаевым и др.) баллонный катетер, который вводим ретроградно через артериотомию задней большеберцовой артерии в области медиальной лодыжки. Он имеет приспособление для последовательного соединения двух катетеров, что позволяет осуществлять проведение их по кругу, используя два баллончика (рис. 10).
После удаления эмбола и тромбов проверяют проходимость артерии путем пробного кровопускания с дис-тального и проксимального ее сегментов. Мощный пульсирующий кровоток из центрального отдела артерии свидетельствует о полном удалении эмбола. Из дистального сегмента при этом наблюдается достаточно сильный
непульсирующий ретроградный кр воток. Недостаточность кровотока i центрального или периферического о делов артерии является показателе неполного удаления эмбола, возмог ной «этажной» эмболии или налич^ продолженного тромба, и, следов, тельно, необходимо продолжать попытки полного освобождения сосудо
После удаления эмболов и тромбов проксимальный и дистальный учас ки артерии вводят раствор гепарин; в дистальное сосудистое русло цел* сообразно ввести сосудорасширяюгщ средства (2 мл 2% раствора папаверина или но-шпы). Операцию заканчивают наложением сосудистого ше на артерию. Поперечную рану арт< рии ушивают непрерывным обвивны швом, продольную — с использов; нием аутовенозной заплаты или обви] ным продольным швом при диаметр сосуда больше 8 мм.
Тромбэндартериэктомия.
В отличие от простой тромбэктомии при это способе дезоблитерации удаляю тромб вместе с патологически измененной интимой, а нередко и с мышечной оболочкой. Измененная внутренняя оболочка удаляется при этом н только на участке полной закупорки сосуда, но и в местах выраженной сужения его просвета (эндартерэкто мия).
Этот метод дезоблитерации при меняют при дегенеративных и воспалительных изменениях сосудистой стенки, в наибольшей степени выраженных в интиме вследствие атеро склероза, эндартериита, посттромбо эмболической облитерации. Отслаивание обтурирующего субстрата легче достигается при выраженном, «созревшем» атеросклеротическом поражение стенки сосуда, в то время как при наличии отдельных атеросклеротически* бляшек с участками малоизмененной интимы между ними осуществить полное удаление интимы технически трудно или невозможно. Значительные трудности возникают также при атероматозном изъязвлении, глубоком очаговом кальцинозе или склеротическом перерождении всей сосудистой стенки. Таким образом, у некоторых больных не удается выполнить тромбэндарте-риэктомию. Определить этих больных до операции часто невозможно, поэтому необходимо всегда быть готовым к применению трансплантации сосудов. Можно предполагать с известной долей вероятности, что у больных старше 55 лет с длительностью заболевания свыше 2 лет атеросклеротический процесс в сосуде находится в стадии, когда показано выполнение дезоблитерации (Vollmar, 1967).
Отслойку обтурирующего субстрата производят между внутренней и средней оболочками (по внутренней эластической мембране), в мышечном слое (легко определить по наличию циркулярных мышечных волокон) или вне мышечной оболочки таким образом, что остаются практически только адвентиция и наружная эластическая мембрана (рис. 11). Однако даже в последнем случае сосудистая стенка артерий конечностей обычно остается достаточно прочной и состоятельной.
Различают два основных способа операции — открытую и полуоткрытую (полузакрытую) эндартериэкто-мию. Некоторые авторы выделяют также закрытую тромбэндартериэкто-мию (М. Д. Князев и соавт., 1971).
Открытая эндартериэктомия.Ок-клюзированный сегмент артерии выделяют при этом методе на всем протяжении, а реканализацию его производят с использованием нескольких способов. Хирург видит весь обтурирую-щий субстрат и внутреннюю поверхность сосуда после его удаления. Это позволяет тщательно удалить внутреннюю оболочку и обеспечить гладкую внутреннюю поверхность сосуда.
При классическом способе открытой эндартериэктомии измененную интиму и тромб удаляют через широкое продольное сечение артерии на всем протяжении окклюзированного сегмента (рис. 12). На крупных сосудах диаметром больше 8 мм, главным образом аорте и подвздошных артериях, место сечения ушивают обвивным швом (Dickinson и соавт., 1967; Spiro, Cotton, 1970). С целью предупреждения сужения сосудов среднего калибра, например бедренной, подколенной, плечевой артерий, производят пластику их длинной аутовенозной заплатой из большой подкожной вены (Б. В. Петровский и соавт., 1965; К. Ю. Литманович, 1967, и др.). В настоящее время этот метод используют редко — при ограниченных (5—8 см) окклюзиях крупных или средних артерий (общей подвздошной, общей бедренной) обычно в сочетании с аутовенозной боковой пластикой или как дополнительное вмешательство при реконструкции методом обходного шунтирования.
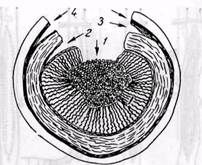
Рис. 11.Слои стенки артерии, по которым отделяют тромбинтимальный секвестр притромб-эндартериэктомии в зависимости от характера патологического процесса:
удаление тромба Ц), эндартериэктомия по внутренней эластической мембране (2). в мышечном слое (<?) и по наружной эластической мембране (4)
Существенно не отличается от классического метод открытой эндартериэктомии через множественные артериотомии в области окклюзированного сегмента. В настоящее время эту операцию также обычно не применяют.
Достоинством открытого способа является то, что измененную интиму тщательно удаляют под визуальным контролем, и обеспечивается относительно гладкая внутренняя поверхность сосуда. Однако метод имеет ряд недостатков, которые особенно выявляются при выполнении эндар териэктомии на большом протяжении: травматичность, так как неизбежно пересечение коллатералей; наклонность к тромбозу вследствие рассечения стенки на значительном протяжении с последующим ее ушиванием; большая продолжительность оперативного вмешательства в связи с выделением всего окклюзированного участка еосуда и ушиванием большого дефекта. Последнее обстоятельство обусловливает также длительное нарушение кровообращения в тканях, что нередко приводит к осложненному заживлению ран.
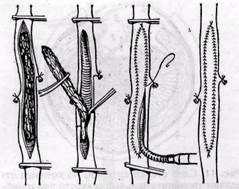
Рис. 12.Схема этапов открытой эндартериэктомии
В последние годы получила распространение операция «выворачивающей» (эверсионной) эндартериэктомии, которая, в сущности, является вариантом открытого способа, так как позволяет ревизовать визуально внутреннюю поверхность сосуда. Различают два способа эверсионной эндартериэктомии: через одно полное поперечное сечение артерии (De Bakey и соавт., 1959) и с резекцией и реимплантацией сосуда (Б. В. Покровский и соавт., 1971; М. Д. Князев и др., 1971; Harrison, 1967; Connolly, 1968).
При первом варианте обтуриро-ванный сегмент артерии выделяют на всем протяжении с пересечением коллатералей. Артерию пересекают дис-тальнее места окклюзии и с помощью сосудистого шпателя отслаивают об-турирующий тромб, адвентицию и
мышечную оболочку выворачивают наизнанку до конца тромба. Последний удаляют единым слепком, из внутренней поверхности сосуда удаляют остатки интимы. После этого артерию вновь «вворачивают» и ана-стомозируют с дистальным концом артерии конец в конец.
Мы применяем эту операцию при реконструкции сегментарных атеро-склеротических окклюзии небольшой протяженности в аорто-подвздошно-бедренной области. При этой методике нередко удается сохранить внутреннюю подвздошную артерию.
При втором способе окклюзиро-ванный сегмент артерии полностью выделяют с пересечением коллатералей и резецируют. Вне операционной раны наружную оболочку отделяют от обтурирующего секвестра путем выворачивания, как описано выше. Производят визуальную ревизию внутренней поверхности сосуда, удаляют обрывки интимы, после чего сосуд обратно «вворачивают», проверяют его герметичность и накладывают два анастомоза конец в конец. Получают в сущности аутопротез сосуда.
Преимущество эверсионного метода по сравнению с другими способами открытой эндартериэктомии состоит в том, что отпадает необходимость в продольном рассечении артерии и последующей боковой аутовенозной пластике. Эверсионная эндартериэктомия сохраняет основные недостатки открытого метода: травматичность, пересечение всех коллатералей и нервных связей. Эверсионный метод применяют и в настоящее время при реконструкции аорто-подвздошно-бедренного сегмента (М. Д. Князев и соавт., 1971; М. В. Даниленко с соавт., 1976). Результаты операции, по мнению ряда авторов (Connolly, Stemmer, 1970, 1972, и др.), лучше, чем при аор-то-бедренном шунтировании аллопро-тезом. Однако эверсионная эндартериэктомия может быть выполнена далеко не всегда, особенно при выраженном склеротическом перерождении всей стенки артерии, кальцинозе ее, «незрелом» атеросклеротическом поражении.
Располагая опытом применения эверсионной эндартериэктомии при реконструкции аорто-подвздошного сегмента и у небольшого числа больных — поверхностной бедренной артерии, мы убедились в том, что этот метод не имеет преимуществ перед обходным шунтированием и резекцией с протезированием. В настоящее время мы используем этот метод редко.
Полуоткрытая эндартериэктомия.Сущность метода заключается в том, что тромб и измененную интиму удаляют через отдельные, обычно 1— 2, небольшие разрезы артерии с помощью специальных инструментов. Этот метод в настоящее время применяют ряд авторов при реконструкции сосудов крупного и среднего калибра.
Преимущества полузакрытого способа: меньшая травматичность, большая физиологичность операции, так как представляется возможным сохранить важные коллатерали, нервные связи и питающие артериальную стенку сосуды. Эти обстоятельства создают благоприятные условия для регенерации сосудистого эндотелия. Важными обстоятельствами являются также меньшая продолжительность операции и небольшие разрезы артерии, что уменьшает опасность тромбообразо-вания.
Техника операции через два разреза артерии разработана Cannon и Barker (1953, 1955). Обтурирующий сегмент артерии выделяют не по всей длине, а в его проксимальной и дис-тальной частях. В этих местах артерию рассекают продольно (разрез длиной 2—2,5 см), обтурирующий секвестр отслаивают и удаляют через отверстия с помощью специальных инструментов (рис. 13). Cannon предложил сосудистый распатор, имеющий форму кольца, фиксированного на спице. Кольцо надевают на тромб, а затем продвигают по нему в необходимом слое, отслаивая от наружной оболочки. Vollmar (1966, 1967) считает важным для успешной отслойки обтури-рующего цилиндра принцип спиральной диссекции с помощью предложенного им кольца, расположенного под углом 135° к спице. При поступательно-круговых движениях кольца облегчается отслойка тромба. Инструмент вводят ретроградно. Автор считает полузакрытую эндартериэктомию методом выбора при реконструкции окклюзии периферических артерий конечностей.

Рис. 13. Схема полуоткрытой тромбэндартериэктомии:
/ — этапы операции, выполняемой с помощью интимотромбэкстрактора нашей конструкции и кольца Вольмара;
2 — илструменты для тромб-эндартериэктомии
а — кольцо Cannon;
б — кольцо Краковского — Золоторевского;
в — кольцо Vollmar;
г — диссектор Lee Veen;
д — интимо-тромбэкстрактор нашей конструкции)
С целью меньшей травматичности Н. И. Краковский (1959) предложил модификацию операции полузакрытой эндартериэктомии из одного разреза артерии с помощью сосудистого распатора оригинальной конструкции. В отличие от кольца Cannon рабочая часть сосудистого распатора выполнена в виде металлической трубки, которую надевают на тромб. Эта особенность инструмента обеспечивает устойчивость распатора в процессе отслойки тромба и продвижение его без перекосов и смещений. Описанную модификацию полузакрытой эндарте-риэктомии автор применял в основном у больных облитерирующим эндартериитом, когда тромб достаточно прочный, тонкий, равномерного диаметра. Инструменты с рабочей частью в виде кольца имеют тот недостаток, что при неодинаковом диаметре тромбов на различных участках сосуда, а также рыхлой структуре тромба, характерной для атеросклеротических окклюзии, .возникают значительные технические трудности или операция полузакрытым способом не удается.
Приведенные соображения послужили поводом к поискам новой конструкции инструментов и методов для эндартериэктомии полуоткрытым способом.
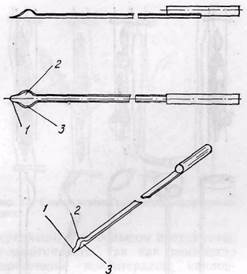
Рис. 14. Интимотромбэкстрактор нашей конструкции (1 — передняя; 2, 3 — боковые, режущие кромки полукольца)
Мы (А. А. Шалимов с соавт., 1973) разработали интимотромбэкст-рактор, отличительная особенность которого состоит в том, что рабочая часть, в отличие от вышеописанных приспособлений, выполнена в виде полукольца, которое имеет опережаю-
щую режущую кромку по типу распатора, расположенную в его центральной части, и две размещенных за нею режущие кромки, расположенные на боковых поверхностях этого полукольца (рис. 14). Инструмент состоит из ручки, штанги и рабочей части. Он изготовлен в 6 вариантах с различным радиусом и длиной дуги полукольца, а также различной длиной штанги.
Полуоткрытую эндартериэктомию мы выполняем обычно через продольную артериотомию. Определяют оптимальный слой для отделения тромбин-тимального секвестра и в этот слой вводят рабочую часть инструмента. При поступательно-вращательных движениях интимотромбэкстрактора центральные и боковые режущие кромки разъединяют спайки между тром-ботической массой и наружной оболочкой стенки сосуда. Неодинаковый диаметр тромбов на различных участках сосуда не является препятствием для выполнения эндартериэктомии. Рукоятка и упругоэластичная штанга обеспечивают необходимую устойчивость распатора и направление его движения. Окончательное извлечение тромба после его отслойки может быть осуществлено обычным сосудистым зажимом.
Эндартериэктомия с использованием интимотромбэкстрактора выполнена в течение 4 лет более чем у 70 больных с окклюзиями периферических артерий. Применение интимотромбэкстрактора малых размеров оказалось эффективным также при операциях на сосудах относительно малого калибра: глубокой бедренной, внутренней подвздошной, задней боль-шеберцовой артерий. Клинический опыт показал эффективность, надежность и удобство применения инструмента. Перфорация стенки артерии наблюдалась у единичных больных при склеротическом перерождении стенки сосуда с кальцинозом бляшек и изъязвлением.
Особенно эффективно применение интимотромбэкстрактора в сочетании с газовой карбодиссекцией. Метод газовой диссекции, предложенный впервые в 1964 г. Nelson и Sander для разделения тканей, нашел применение в реконструктивной хирургии. Его используют для дезоблитерации периферических артерий конечностей, почечных, сонных и коронарных артерий (А. А. Шалимов с соавт., 1973; Kaplit и соавт., 1967; Brunner, 1970).
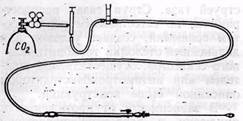
Рис. 15.Схема газового карбодиссектора
Метод газовой эндартериэктомии мы применяем с 1972 г.
Сущность метода карбодиссекции заключается в субадвентициальном введении регулируемой струи углекислого газа, что позволяет отслоить тромбинтимальный атеросклеротический субстрат от наружной оболочки. Хорошая физическая растворимость углекислого газа в крови (0,48 мл углекислого газа в 1 мл крови), а также его способность к химическому растворению, связыванию в виде бикарбонатов почти полностью исключают опасность газовой эмболии (Sawyer и соавт., 1968).
Нами сконструирован специальный аппарат для регулируемой подачи газа, ручка-карбодиссектор, набор шпателей различной формы, диаметра и длины, а также определены оптимальные параметры подачи газа (А. А. Шалимов и соавт., 1973; Ю. Э. Полищук и соавт., 1973).
Приспособление смонтировано на подвижной тележке и состоит из баллона с углекислым газом, соединенного через двухкамерный редуктор посредством вакуумных шлангов с вентилем тонкой регулировки газа и ротаметром. Ротаметр показывает скорость газопотока, с помощью вентиля осуществляется регулирование объема подачи газа, и он исключает возможность поступления газа в рану под большим давлением в случае неисправности редуктора. Кран окончательной подачи газа вмонтирован в специальную ручку, имеющую канюлю для насадки газовых шпателей (рис. 15). Ручку с краном и набором шпателей стерилизуют и используют во время операции. Мы применяем различные газовые шпатели для эндартериэктомии двух основных типов. Первый тип — в виде игл различной длины, диаметра и формы плоского сопла с боковыми отверстиями для подведения газа в сосуд — предназначен только для газовой дис-секции. Второй тип — выполнен по форме вышеописанного интимотромб-экстрактора нашей конструкции с вмонтированной на внутренней поверхности полукольца тонкой иглой для подведения газа (рис. 16). Таким образом, шпатели второго типа объединяют в себе свойства механического и газового диссектора: при поступательно-вращательных движениях инструмента опережающая струя газа производит атравматическую отслойку тканей с дополнительным механическим их расслаиванием режущими кромками.
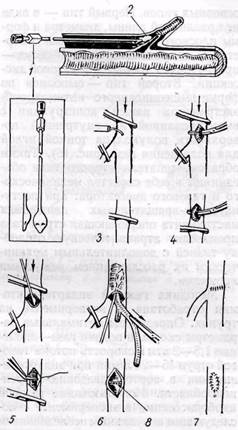
Рис. 16. Схема операции тромбэндартериэк-томии с помощью газовой карбодиссекции:
1— газовый шпатель; 2 — отслойка газовой дис-секцией тромбинтимального секвестра в устье боковой ветви артерии; 3 — введение углекислого газа под адвентицию; 4,5 — отслойка тромбинтимального секвестра с помощью струи газа и механическим путем; 6 — эндартериэктомия из проксимального сегмента артерии; 7 — шов и венопластика артерии; 8 — дистальный край интимы фиксирован П-образным швом
Методика газовой эндартериэкто-мии отработана в эксперименте на трупах. Определены оптимальные параметры скорости подачи газа—давление 1,5—2 атм и скорость потока газовой струи 15—20 л/мин при эндартери-эктомии в аорто-подвздошно-бедрен-ной области. Использование газовой карбодиссекции в эксперименте с последующим визуальным исследованием внутренней поверхности сосуда показало важную особенность метода: газовая диссекция позволяет отслоить и удалить измененную интиму и тромбы также из устьев боковых ветвей артерии, восстанавливая и сохраняя их просвет (рис. 16). Это важное обстоятельство отметили также Sawyer и соавторы (1968).
Эндартериэктомия методом карбодиссекции применена в клинике у 24 больных при реконструкции сосудов аорто-подвздошной и бедренно-подколенной областей. Техника операции схематически представлена на рис. 16. Выделяют проксимальный и дистальный участки окклюзирован-яой артерии. Вводят субадвентициаль-но струю углекислого газа и рассекают продольно наружную оболочку. В субадвентициальный слой вводят газовый шпатель необходимого диаметра и формы и производят диссекцию
струей газа. Струя газа, распространяясь по естественным неплотностям сращений, создает условия для дальнейшей отслойки тромбинтималь-ного секвестра, осуществляемой шпателем или интимотромбэкстрактором описанной выше конструкции.
В зависимости от протяженности окклюзии и характера поражения тромбэндартериэктомию выполняют через одну или две артериотомии без выделения сосуда на всем протяжении и без перевязки боковых ветвей. Метод оказался эффективным также при эндартериэктомии из сосудов малого диаметра: глубокой бедренной, устьев берцовых артерий. Применение метода упрощает и ускоряет выполнение полуоткрытой эндартериэктомии без выделения всего окклюзированного сегмента артерии, позволяет сохранить коллатеральные сосуды и частично восстановить их проходимость, облегчает выполнение эндартериэктомии из сосудов малого диаметра. Аппарат и инструменты просты и надежны.
При выполнении полуоткрытой эндартериэктомии, особенно через одну артериотомию, могут возникнуть затруднения в удалении из артерии отслоенного с помощью инструментов тромбинтимального секвестра. В случае рыхлой структуры последнего и неравномерного поражения интимы сосуда атеросклеротическим процессом отслоенный тромб при извлечении может легко обрываться. Для удаления тромба мы используем различные приспособления: длинные сосудистые зажимы, а в последнее время разработанный нами совместно с И. И. Сухаревым и другими специальный криохирургический инструмент — крио-тромбэ кстра ктор.
Аппарат для выполнения эндартериэктомии при низких температурах был предложен в США. Криохирургический инструмент состоит из корпуса и удлиненного шпателя, на одной поверхности которого создается температура ниже точки замерзания. Противоположная поверхность зонда остается относительно теплой. После отслойки тромбинтимального субстрата шпатель вставляют в артерию между тромбом и наружной оболочкой таким образом, что холодная сторона соприкасается с тромбом. Шпатель охлаждают, тромб примерзает к нему, после чего его извлекают вместе со шпателем.
Усовершенствованный нами аппарат для удаления тромбов и атеро-склеротических секвестров соединяет в себе свойства карбодиесектора и криотромбэкстрактора. Он состоит из корпуса и шпателя (рис. 17). В корпусе размещена емкость, соединенная с одной стороны с источником хладо-агента (жидкий азот) и введенная в контакт с хвостовиком шпателя для охлаждения последнего. Поверхность шпателя, примыкающая к наружной оболочке сосуда, снабжена теплоизолирующим покрытием. Стенка шпателя полая и соединена с источником углекислого газа, что обеспечивает подведение газа к отверстиям, расположенным на боковой и передней поверхностях конечной (рабочей) части шпателя. Аппарат снабжен, в отличие от ранее известных аналогичных приспособлений, дополнительным размораживающим нагревателем, автоматически соединенным с механизмом отключения подачи хладоагента и терморегулятором с термопарой (спай размещен в шпателе) для регулирования заданной температуры замораживания. Шпатели съемные, изготов^ лены в нескольких вариантах в зависимости от их длины и толщины. Источником хладоагента служит система, включающая баллон с жидким азотом и блок управления.
Криотромбэкстрактор работает следующим образом. Через разрез стенки сосуда вводят шпатель между атеросклеротическим субстратом и наружной оболочкой. При перемещении шпателя углекислый газ, выходящий на переднюю и боковую поверхности рабочей части шпателя, отделяет тромбинтимальный субстрат. После отслойки последнего перекрывают поток газа и включают подачу хладоагента. Шпатель охлаждается до заданной (—70, —73° С) температуры. При этом нагреватель по электрическому сигналу термопары осуществляет точное регулирование температуры. Со стороны наружной оболочки шпатель термоизолирован, со стороны тромба — охлажден, в связи с чем происходит примерзание тромба к шпателю. Последний извлекают из сосуда вместе с тромбом.

Рис. 17.Криотромбэкстрактор нашей конструкции:
/ — корпус; 2 — шпатель; 3,4 — отверстия, через которые подводится углекислый газ; 5 — рабочая часть шпателя; 6 — соединение с источником
хладоагента
В случае примерзания наружной оболочки включают дополнительный нагреватель с одновременным автоматическим отключением подачи хладоагента. При необходимости повторного примораживания тромба или секвестра вновь включают подачу хладоагента.
Предложены также аппараты для эндартериэктомии, основанные на использовании колебательных движений и ультразвука. Так, в США выдан патент на аппарат для эндартериэктомии, который генерирует механические колебательные движения. Последние передаются на зонд, дисталь-ный конец которого имеет вид петли. Зонд вводят в артерию между средней и наружной оболочками. Колебательные движения петли приводят к раз- делению этих слоев и освобождению тромбинтимального субстрата.
Механические вибрации в звуковом и ультразвуковом диапазоне также используют для удаления атеро-склеротических отложений из артерий. Аппарат генерирует ультразвуковую энергию и приспособлен для отделения холестериновых отложений в кровеносных сосудах от неизмененной оболочки без повреждения окружающих тканей. По мнению авторов, аппарат обеспечивает быстрое удаление отложений, позволяет избежать повреждения, прорыва или разрыва сосуда.
Мы перечислили основные из многочисленных способов, инструменты и аппараты, предложенные для выполнения эндартериэктомии.
Уже то обстоятельство, что их много, побуждает хирургов проводить дальнейшие исследования. Мы используем большинство из указанных выше методов и инструментов, что позволяет применять их в зависимости от характера и протяженности сосудов, а также от различных ситуаций, возникающих во время операции. В том случае, если не удается выполнить эндартериэктомию качественно, применяем трансплантацию сосудов.
В отношении техники операции эндартериэктомии мы считаем важным подчеркнуть следующие основные положения.
Артерию рассекают на уровне дис-тального конца окклюзированного сегмента сосуда. Обычно мы используем продольный разрез длиной 1,0— 2,0 см для обеспечения достаточно свободного доступа к тромбу и возможности наложения анастомоза конец в бок при необходимости применения обходного шунтирования. Определяют оптимальный слой для отслаивания тромбинтимального субстрата с помощью сосудистого шпателя или зажима типа москит. Интиму пересекают поперечно таким образом, чтобы ее дистальный край был расположен выше дистального угла разреза артерии.
Эндартериэктомию из одного разреза производят обычно ретроградно, из двух разрезов — в обоих направлениях между разрезами и дополнительно, при необходимости, ретроградно из проксимальной артериотомии. Из одного разреза операцию выполняют при небольших по протяженности окклюзиях—до 10см. При окклюзиях большей протяженности целесообразно делать два разреза. Второй разрез производят над проксимальной границей окклюзии или же в области пораженной бифуркации артерии.
Ретроградная эндартериэктомия является методом выбора, однако по специальным показаниям применяют и ортоградную полузакрытую эндартериэктомию: из крупных боковых ветвей (например, внутренней подвздошной, глубокой бедренной, передней берцовой артерий); для удаления гиалинизированного белого тромба при облитерирующем эндарте-риите (методика Н. И. Краковского).
Чрезвычайно важным моментом является надежная фиксация дистального края срезанной интимы к стенке сосуда. При наличии флотирующего края интимы и значительном ее утолщении с образованием уступа под воздействием тока крови может произойти отслойка внутренней оболочки, подворачивание (инвагинация) ее края и перекрытие просвета сосуда (рис. 18, а). Это одна из наиболее частых причин послеоперационного ретромбоза оперированного сосуда.
Для профилактики этого осложнения считаем целесообразным следующие приемы: пересечение интимы в пределах малоизмененного участка сосуда; срезание ее под острым углом на уровне артериотомии; фиксация края интимы к сосудистой стенке П-образ-ными швами, а также частичное захватывание его в шов при наложении заплаты или анастомоза; перекрытие края интимы заплатой, с тем чтобы обеспечить некоторое расширение просвета в этом участке сосуда (рис. 18, б).
Важным моментом операции является контроль проходимости арте- рии после ее дезоблитерации. Оставление обрывков интимы на внутренней поверхности оперированного сосуда может быть причиной послеоперационных тромбозов. Контроль восстановленного сегмента сосуда осуществляем путем ощупывания доступных его участков, проведения бужей соответствующего диаметра, промывания сосуда физиологическим раствором под давлением в обоих направлениях, тщательного осмотра удаленного тромбинтимального субстрата с целью выявления в нем дефектов.
Перед ушиванием артерии освобождаем сосуд от зажимов, промываем рану кровью с целью удаления тромбов, в проксимальное и дисталь-ное сосудистое русло вводим раствор гепарина.
Шов артерии осуществляем описанными выше способами обычно с аутовенозной пластикой заплатой. Вначале снимаем зажим с дистального отдела сосудистой магистрали, проверяем герметичность шва, а затем снимаем центральный зажим.
Перед зашиванием раны мягких тканей обязательна проверка проходимости сосуда по пульсации дисталь-ных участков артерии или методом флоуметрии. При сомнениях в отношении проходимости сосуда, подозрении на наличие обрывков или флотирующего края интимы показана контрольная операционная артериография.
Эндартериэктомия является весьма сложной операцией. Успех ее в значительной степени определяется правильным и тщательным выполнением всех этапов операции, особенно эндар-териальных манипуляций. Могут быть следующие основные ошибки и осложнения операции.
Прорыв (разрыв) стенки артерии при грубом, неправильном манипулировании сосудистыми шпателями типа кольца или полукольца при отделении тромбинтимального субстрата; в результате захватывания стенки сосуда зажимами при извлечении отслоенного тромба; при отделении кальцинированной бляшки, поражающей
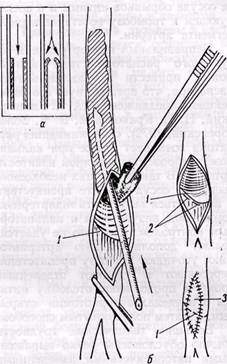
Рис. 18. Метод предупреждения подворачивания (а) края пересеченной при тромбэндарте-риэктомии интимы (б):
пересечение интимы (Л под острым углом на уровне артериотомии в пределах малоизмененного участка артерии, фиксация ее края П-образными швами (2) и перекрытие края интимы венозной
заплатой (3)
всю стенку сосуда; при бужировании сосуда. Угроза разрыва стенки сосуда возникает при неравномерном поражении сосудистой стенки, выраженном кальцинозе, атероматозной язве. Разрыв стенки, особенно не диагностированный во время операции, может осложниться параартериаль-ным кровотечением и последующим тромбозом восстановленной артерии. Правильное определение показаний к операции эндартериэктомии, тщательное, щадящее оперирование с использованием усовершенствованного инструментария позволяет предупредить возникновение этого осложнения. Неправильный выбор слоя отделения тромбинтимального субстрата может привести к «разноэтажной» эндартериэктомии, оставлению в просве- те сосуда обрывков интимы и в последующем к тромбозу восстановленного сегмента артерии.
Неправильный подбор размера сосудистого распатора типа кольца может привести к «заклиниванию» распатора, что препятствует его дальнейшему продвижению (А. А. Вишневский, Н. И. Краковский, В. Я. Золо-торевский, 1972). «Заклинивание» распатора возникает также при кальци-нозе, фиброзе, выраженной извитости артерии. В таких случаях необходимо выделить сосуд в месте препятствия и попытаться выполнить эндартериэк-томию под визуальным и пальпатор-ным контролем. Если это не удается, делают дополнительную артериото-мию, уточняют причину препятствия, пересекают и удаляют отделенный тромб и продолжают отслойку интимы в пределах артериотомии открытым, а затем полузакрытым епособом.
Большие технические трудности обычно обусловлены резко выраженными патологическими изменениями сосудистой стенки вследствие кальци-ноза или фиброза артерии. В последнем случае сосуд имеет вид плотного, относительно тонкого жгута. Иногда можно попытаться расширить просвет сосуда путем бужирования (А. А. Вишневский и соавт., 1972). Мы отмечали склонность к ретромбозам после этого вмешательства, поэтому считаем более целесообразной в таких случаях трансплантацию сосудов.
Тромбоз оперированного сегмента на операционном столе развивается вследствие технических ошибок (оставление в просвете обрывков интимы или флотирующего дистального ее края, сужение просвета сосуда в месте шва) или при резком усилении коагуляционных свойств крови. Необходимо проверить время свертывания крови, ввести раствор гепарина в проксимальное и дистальное сосудистое русло, произвести ревизию оперированного сосуда и удалить тромб. Вопрос о месте артериотомии — по линии сосудистого шва или на новом участке — решают индивидуально, однако первое
и второе правомочно при соответствующих показаниях.
Несостоятельность участка стенки оперированной артерии проявляется кровотечением или имбибицией сосудистой стенки кровью. В этом участке возникают благоприятные условия для ретромбоза, параартериальной гематомы и аневризмы. Вопросы тактики при этом осложнении решают индивидуально: наложение П-образных швов, рассечение артерии и пластика аутовенозной заплатой, резекция сегмента артерии с последующей аллопластикой его веной.
Основываясь на собственном опыте, мы пришли к выводу, что при значительных технических трудностях, ошибках, осложнениях эндартериэк-томии целесообразно руководствоваться правилом: лучше изменить план операции и применить трансплантацию сосудов, чем выполнить эндарте-риэктомию некачественно.
Регенерация сосудистой стенки после эндар-териэктомии изучена в эксперименте и в клинике (М. Г. Маслова, 1963; В. Я. Золоторевский, 1972; Г. Д. Князева и М. М. Морозова, 1973). Исследования показали, что уже через несколько часов дефект интимы покрывается тонким слоем фибрина. Фибрин является питательной средой для тканевых элементов формирующейся соединительной ткани и стимулирует пролиферацию мезенхималь-ных клеток сосудистой стенки (И. В. Давыдовский, 1961). В дальнейшем происходит замещение фибрина соединительной тканью в основном за счет пролиферации соединительнотканных клеток интимы и среднего слоя. Через 2—6 мес на внутренней поверхности сосуда обнаруживается неоинтима, богатая клеточными элементами, выстланная изнутри слоем клеток, напоминающих сосудистый эндотелий. Через 1 год после операции количество клеток уменьшается, обнаруживаются эластические элементы (Г. Д. Князева, М. М. Морозова, 1973). Однако другие авторы не наблюдали регене- рации эластических волокон в неоинтиме., а только коллагеновые волокна (В. Я. Золоторевский, 1972).
В более поздние сроки после операции у единичных больных отмечается кальциноз, склероз неоинтимы, кровоизлияния под нее, аневризмати-ческие расширения.
Результаты исследований в целом показывают, что восстановительные морфологические процессы в сосудистой стенке после эндартериэктомии развиваются вполне удовлетворительно. Это обосновывает применение операции в клинике. Есть основания считать, что при сохранении внутренней эластической мембраны, а также в случае, когда сосуд полностью не отделяется от окружающих тканей (сохранение иннервации и сосудистых связей), репаративные процессы проходят более благоприятно.
ТРАНСПЛАНТАЦИЯ СОСУДОВ
С конца XIX в. и до наших дней были предложены разнообразные материалы для замены сосудов — биологические (сосуды и другие ткани) и аллопластические (искусственные сосудистые протезы). Из многих способов реконструкции артерий методом трансплантации, исследованных в эксперименте и апробированных в клинике, в настоящее время применяют главным образом два: пластика артерий веной и аллопластика синтетическими сосудистыми протезами. Другие оставлены как непригодные или их используют очень ограниченно, например, пересадку ауто-, гомо- и гетероартерий, гомовены.
Практическая ценность трансплантатов, используемых для пластики артерий, определяется биологической совместимостью, механическими свойствами (прочность, эластичность, упругость), влиянием на троМбогенез, характером и частотой осложнений в ближайшие и отдаленные сроки после операции. Важна также доступность,
то есть возможность иметь трансплантат достаточной длины и диаметра.
Трансплантация аутовеныв настоящее время является основным методом реконструкции снабжающих артерий среднего и малого калибра (диаметром меньше 8 мм).
Аутовенозная пластика впервые была разработана в эксперименте и применена в клинике Carrel (1902, 1906). Первые успешные пересадки аутовены были применены для замещения дефектов артерий, возникших после резекции аневризм: Govenes (1906) использовал подколенную вену для замещения дефекта подколенной артерии методом in situ. Lexer (1907) осуществил свободную пластику сегментом большой подкожной вены бедра дефекта подмышечной артерии.
В 1949 г. Kunlin использовал большую подкожную вену бедра для обходного шунтирования окклюзиро-ванной бедренной артерии. С конца 50-х годов аутовенопластика находит все более широкое применение в хирургии тромбоблитерирующих заболеваний артерий (Dale, Mavor, 1959; Linton, Darling, 1962, 1967; OeWeese исоавт., 1966). Мы (А. А. Шалимов, 1961) впервые предложили методику замены и шунтирования периферических артерий одноименной сопровождающей веной без выделения ее из ложа (методом in situ) при реконструкции артерий по поводу облите-рирующих заболеваний. Большинство авторов в настоящее время считают аутовенозную пластику наиболее предпочтительным методом реконструкции артерий среднего и малого калибра.
Это обусловлено биологической совместимостью, относительной доступностью и простотой изъятия вены, эластичностью, устойчивостью ее к инфекции и относительно низкими тромбогенными свойствами. Наличие неизмененной интимы обеспечивает продолжительное функционирование аутовенозного трансплантата.
Питание относительно тонкой стенки вены в начальный период после свободной пересадки происходит за счет крови, проходящей в ее просвете. Через 2—3 нед после трансплантации восстанавливаются сосудистые связи наружной оболочки вены с окружающими тканями. Дегенерация и склероз ее стенки обычно не выражены в значительной степени и сохраняются эластические элементы ткани, обусловливающие механическую прочность и стабильность стенки восстановленного сосуда.
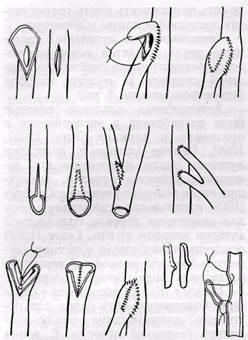
Рис. 19.Методы формирования анастомоза венозного шунта и артерии при малом калибре проксимального конца венозного шунта
Компенсаторно-приспособительные изменения в ответ на высокое артериальное давление в функционирующем аутовенозном трансплантате проявляются утолщением ее стенки, гиперплазией интимы и мышечного слоя. Происходит так называемая ар-териализация вены (Б. И. Даценко, 1964; May и соавт., 1965).
Наряду с указанными достоинствами аутовенозная пластика имеет ряд недостатков. Отмечено образование аневризм стенки пересаженной вены
через несколько месяцев или лет после операции. Они развиваются чаще в результате недостаточности стенки по линии шва. Гладкое приживление трансплантата без выраженной воспалительной реакции, инфекции и гематомы является лучшей мерой предупреждения неполноценности его стенки.
Недостатком метода является также отсутствие у части больных венозных аутотрансплантатов необходимой длины и диаметра.
В случае несоответствия длины или диаметра аутовенозного трансплантата параметрам дефекта артерии может быть использована следующая тактика (рис. 19): увеличение диаметра проксимальной части венозного шунта путем сшивания двух вен (Mercier и соавт., 1972) или основного ствола и его боковой ветви после их продольного рассечения; методика анастомоза бок в бок с подворачиванием края венозного шунта и расширением его начального отдела; увеличение диаметра анастомоза с помощью свободного треугольного лоскута из вены или продольного лоскута, выкроенного из артерии; удлинение трансплантата путем анастомозирования двух вен конец в конец (с помощью сосудосшивающего аппарата), вены и сегмента артерии (после дезоблитера-ции последней) или использования основного венозного ствола и его крупной боковой ветви, вены и аллопро-теза.
Техника операцииаутовенопластики артерий заключается в следующем. Выделяют большую подкожную вену бедра и убеждаются в соответствии ее диаметра, отсутствии облитерации ее просвета. Если предполагается наложение анастомоза с бедренной артерией, то вену и артерию выделяют из одного продольного доступа. Начинать операцию в этом случае целесообразно с выделения вены, так как смещение тканей после обнажения артерии нередко затрудняет обнаружение вены. Излишнее рассечение клетчатки и отслойка внутреннего кожного лос- кута при выделении вены могут осложниться некрозом лоскута, что имело место в наших наблюдениях.
При пластике методом обходного шунтирования выделяют только проксимальную и дистальную части ок-клюзированного сегмента артерии. Для успеха трансплантации важно накладывать анастомозы с относительно здоровыми участками артерии про-ксимальнее и дистальнее окклюзии.
Определяют необходимую длину венозного трансплантата и продолжают выделение вены. Изъятие большой подкожной вены на большом протяжении осуществляют через отдельные разрезы по проекционной линии сосуда. Избегают рассечения кожи в области коленного сустава. Некоторые авторы применяют один длинный разрез через все бедро или два больших разреза (Vollmar, 1967).
При выделении вена значительно спазмируется, нередко до половины своего диаметра. Выделение должно быть максимально щадящим, необходимо избегать захвата инструментами стенки вены. Боковые ветви пересекают и перевязывают. Лигатуры необходимо накладывать на некотором расстоянии (1—3 мм) от стенки венозного ствола, чтобы не было сужения, однако не должно быть также «слепых» культей боковых ветвей при оставлении длинной культи перевязанной ветви. Узлы тщательно завязывают тонкой капроновой (1 или 1—0) нитью, учитывая высокое кровяное давление в артериализованном трансплантате.
Просвет вены промывают раствором гепарина. При этом раствор нагнетают шприцем через катетер под давлением с целью проверки ее герметичности и преодоления веноспазма. Удаляют из наружной оболочки обрывки клетчатки, соединительнотканные перетяжки.
Следующий этап — наложение анастомозов. В настоящее время в хирургии облитерирующих заболеваний артерий применяют методику обходного шунтирования с анастомозами как по типу конец трансплантата в бок арте-
рии, так и конец в конец. Анастомозы конец в конец используют чаще при пластике травматических дефектов артерий, после удаления аневризм или при ограниченных по протяженности резекциях артерии.
При наложении анастомоза конец в бок производят продольный разрез артерии длиной примерно 1,5 диаметра венозного трансплантата. При наличии утолщенной, измененной стенки артерии целесообразно иссечь маленький кусочек ее стенки овальной формы с целью предупреждения сужения анастомоза или расширить отверстия в артерии способом, показанным на рис. 20. Расширение проксимального анастомоза аутовенозного шунта при малом диаметре проксимального конца шунта достигаем также с помощью разработанного нами метода с использованием треугольного лоскута стенки артерии (рис. 21).
Применяют обычно непрерывный обвивной шов. Как правило, вкол иглы производят со стороны артерии, что позволяет избежать втягивания адвентиции вены и вворачивания края вены внутрь артерии.
Подготавливают ложе в тканях для трансплантата и последний проводят в туннель с помощью длинного зажима или разработанного нами специально го устройства. Чрезвычайно важно избежать перекручивания по оси, перегиба, сдавления венозного трансплантата в туннеле.
Известны два способа аутовенозного шунтирования артерий конечностей — с реверсией вены и без полного выделения ее из ложа, известного под названием in situ. В первом случае периферический конец вены подшивают к центральному сегменту артерии, а центральный конец вены — к периферическому сегменту артерии. При этом трансплантат полностью извлекается, пересекаются все его боковые ветви, сосудистые и нервные связи и переворачивается (реверсия) на 180° с целью устранения препятствия кровотоку клапанов вены. Шунтирование с реверсией венозного 
Рис. 20. Метод расширения конце-бокового анастомоза вены и артерии при наличии утолщенной и ригидной вследствие патологического процесса стенки артерии
трансплантата в настоящее время является основным методом реконструкции периферических артерий конечностей при облитерирующих заболеваниях в нашей стране и за рубежом. Однако ряд неудач при реверсионном способе шунтирования зависит именно от реверсии трансплантата (May с соавт., 1965, и др.). Они обусловлены возможностью перегиба и скручивания шунта по оси, значительной механической травмой при выделении и извлечении вены, полным нарушением сосудистых и нервных связей, относительно малым диаметром проксимального анастомоза, что нередко приводит к тромбозу шунта.
Указанных недостатков реверсион-ного способа можно избежать при шунтировании веной с оставлением ее в естественном ложе. Метод впервые был применен нами (А. А. Шалимов, 1961) и Hall (1962). Мы применяли вначале для шунтирования одноименную сопутствующую вену, Hall (1962), Rob (1963) — большую подкожную вену бедра. Разрушение венозных клапанов достигалось вначале их иссечением через множественные вено-томии на уровне расположения клапанов.
Рис. 21. Метод расширения анастомоза и устья венозного шунта при малом диаметре проксимальной части шунта
Метод in situ имеет важные преимущества по сравнению с реверсионным способом, особенно при длинном шунтировании от бедренной к подколенной артерии ниже коленного сустава и к берцовым артериям. Относительно большой диаметр проксимального анастомоза обеспечивает лучшие гемоди-намические характеристики шунта, сохранение нервных и сосудистых связей, предохраняет шунт от дистрофических и последующих фиброзных изменений, сокращается продолжительность операции. Однако метод in situ в настоящее время не применяют отечественные хирурги и относительно редко его используют за рубежом в связи с отсутствием надежных способов закрытого, без множественных разрезов венозной стенки, разрушения всех лепестков клапанов. С целью вызывания недостаточности клапанов используют обычно зонды, предназначенные для венэктомии, бужи, катетеры, которые не обеспечивают надежного разрушения всех лепестков клапанов. В последние годы Skagseth и Hall (1973) предложили специальное устройство — разрушитель клапанов.
Нами разработано несколько вариантов специальных устройств для
разрушения клапанов венозного шунта закрытым способом, а также способ разрушения клапанов (см. рис. 118, 119). Применение этих инструментов обеспечивает безопасное и быстрое разрушение клапанов венозного шунта. Это позволяет более широко применять обходное шунтирование веной in situ при реконструкции распространенных окклюзии артерий бедрен-но-подколенно-берцовой области, уменьшить продолжительность операции и улучшить результаты лечения.
После наложения анастомозов вначале снимают дистальный зажим, проверяют герметичность дистального анастомоза, а затем снимают проксимальный зажим. Проходимость шунта и анастомозов проверяют по пульсации и методом флоуметрии.
В технике операции обходного шунтирования веной могут быть допущены ошибки, вследствие чего нарушается ламинарный характер кровотока, возникает турбулентность в области анастомозов с последующим тромбозом шунта. Ошибки обусловлены чаще всего несоответствием длины трансплантата, а также неправильной техникой сосудистого шва (рис. 22).
Тромбоз венозного шунта на операционном столе может быть вызван перекрутом по оси, перегибом, сдавле-нием трансплантата, неполным разрушением клапанов при использовании метода in situ, а также усилением коагуляционных свойств крови. Необходимо выяснить и устранить причину тромбоза. Тромбэктомию из венозного трансплантата мы обычно производим с помощью катетера Fogarty через одну из крупных боковых ветвей венозного трансплантата, предварительно снимая лигатуру, без рассечения шунта.
Сужение проксимального анастомоза при обходном шунтировании с реверсией венозного трансплантата обычно возникает при малом диаметре дистального конца вены. Стеноз приводит к уменьшению объемной скорости кровотока в шунте и линейной скорости в области дистального анастомо-
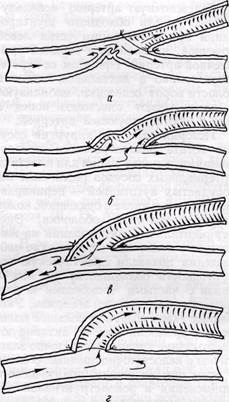
Рис. 22. Ошибки наложения анастомоза вены и артерии конец в бок при обходном шунтировании:
а — короткий шунт, обусловивший деформацию артерии в области анастомоза; 6 — длинный обходной шунт; в, г — неправильно наложенный сосудистый шов (по И. Генову, 1974)
за, что благоприятствует тромбозу шунта. В случае малого диаметра вены мы применяем различные методы расширения анастомоза.
Аутотрансплантация артерийс точки зрения биологической совместимости и свойств сосудистой стенки является оптимальным методом, но его используют очень редко в связи с отсутствием трансплантатов необходимой длины и диаметра просвета. В качестве трансплантата могут быть использованы внутренняя подвздошная, глубокая бедренная артерии. Их применяют некоторые авторы для пластики почечных артерий у больных с ва-зоренальной гипертонией (М. Д. Князев, Г. С. Коротовский, 1971). Селезеночную артерию используют иногда для обходного шунтирования при облитерации устья левой почечной, чревной или верхней брыжеечной артерий. При этом ее пересекают только в дистальном отделе в области ворот селезенки, мобилизуют и накладывают анастомоз конец в бок с соответствующей артерией.
История развития хирургии сосудов богата разнообразными предложениями использования для пластики артериальных сосудов различных несосудистых аутотканей — перикарда, фасции, в том числе с брюшиной, кожи, твердой мозговой оболочки. Экспериментальные исследования на животных и отдельные клинические наблюдения показали практическую непригодность большинства из них в связи с частыми тромбозами и развитием в последующем аневризм. Указанные ткани содержат большое количество тромбокиназы и активируют свертывание крови, недостаточно эластичны и недостаточно прочны. В связи с этим они не нашли практического применения в реконструктивной хирургии артериальных сосудов.
Аллопластика артериальных сосудов. Отсутствие аутогенных сосудов необходимого диаметра, особенно для пластики аорты и крупных артерий — «транспортирующих» сосудов, побуждает к применению гомо-, гетерососу-дов и синтетических сосудистых протезов.
60-е годы были периодом увлечения гомотрансплантацией артерий, которая рассматривалась как метод выбора при пластике аорты и артерий крупного и среднего калибра. Разработка и применение этого метода сыграли большую роль в развитии хирургии сосудов.
Впервые гомопластику артерий у человека, правда безуспешно, осуществил Pirovano в 1910 г. Первую успешную гомотрансплантацию артерий в клинике выполнили Gross и соавторы (1949).
Использовались различные методы консервации артерий в жидких сре-
дах (жидкость Тироде, 4% раствор формалина, 70% этиловый спирт, плазма), а также замораживание. Наиболее широкое применение в клинике (Н. И. Краковский и соавт., 1958; binder, 1955; Hufnagel, 1955, и др.) нашли артериальные гомо-трансплантаты, консервированные методом замораживания и высушивания (лиофилизации), предложенным в 1951 г. Marrangoni и Cecchini.
Однако независимо от вида консервации истинного вживления сосудистых гомотрансплантатов не наблюдается — происходит постепенная резорбция и замещение стенки трансплантата врастающей с окружающих тканей собственной соединительной тканью. Так как стенка трансплантата относительно толстая и плотная, этот процесс осуществляется медленно, может продолжаться в течение 1 года. Еще до врастания соединительной ткани развиваются дегенеративные изменения и даже некробиоз средней и внутренней оболочек. Указанное обстоятельство, особенно разрушение эластических мембран, приводит к нарушению механической прочности стенки и благоприятствует возникновению аневризм. Не отмечено истинной регенерации мышечных волокон. Внутренняя оболочка покрывается фибрином и эндотелием — неоинти-мой.
Таким образом, сосудистые гомо-трансплантаты, как и синтетические сосудистые протезы, являются в сущности каркасом для формирования новой сосудистой стенки из соединительной ткани. Гомотрансплантаты могут также вызывать иммунобиологическую реакцию (П. П. Коваленко, В. Н. Юсков, 1968; Lie и соавт., 1971, и др.).
Гомотрансплантаты крупных сосудов, особенно аорты, могут функционировать продолжительное время. Однако в настоящее время метод практически не применяют в связи с часто развивающимися поздними осложнениями (тромбозы, аневризмы, разрывы, рубцовые сужения, склероз с кальцинозом, вспышки инфекции), а также с широким клиническим использованием более эффективных аллопластических (для замещения крупных сосудов) и аутовенозных (для замещения периферических артерий) трансплантатов.
Гомовенопластику артерий отдельные авторы применяют (Hariola и соавт., 1969; Marcuson и соавт., 1969; Tice, Santoni, 1970; Ochsnez и соавт., 1971; Jackson, Abel, 1972) для бедрен-но-подколенного шунтирования при отсутствии аутовенозного трансплантата необходимых параметров (гипоплазия, облитерация, резко выраженное варикозное расширение большой подкожной вены, ее отсутствие вследствие венэктомии или использование при ранее выполненных реконструктивных операциях). После гомо-венопластики наблюдаются такие же поздние осложнения, как и после пластики артериальными гомотрансплан-татами. Мы также применяем в указанных выше случаях гомовену, консервированную при низких температурах.
В последние годы сделаны попытки использования для обходного шунтирования бедренной артерии пуповин-ной вены (наша клиника, Ibrahim с соавт., 1977, и др.). Однако еще рано делать выводы о перспективности применения этого вида сосудистых трансплантатов.
Экспериментальными исследованиями установлено, что гомотранс-плантаты, как антигены, вызывают состояние иммунитета подобно пересаженной коже и другим органам. Состояние иммунитета не обязательно ведет к тромбозу, хотя тяжесть морфологических изменений трансплантата влияет на частоту его тромбозов (Perloff и соавт., 1972).
Решение проблемы гомопластики сосудов в целом зависит от решения биологической проблемы преодоления реакции антигенной несовместимости тканей.
Попытки пересадки гетеросо-судов предпринимались неодно-
кратно, начиная с экспериментов Carrel (1907). Применяли разные способы обработки трансплантатов для подавления их специфических антигенных свойств. Хотя ближайшие результаты были обнадеживающими, частые поздние осложнения (тромбозы, разрывы, инфекция) заставили отказаться от применения гетеропластики в клинике (Е. Н. Данилов, 1961; Rob, 1962).
Наиболее перспективными для устранения антигенных свойств гете-рососудистых трансплантатов оказались методы ферментной обработки их с целью растворения аутогенных белков (Е. Н. Мешалкин и соавт., 1962; Newton и соавт., 1958, и др.).
В результате соответствующей обработки гетерососуд превращается в биологическую коллагеновую трубку в форме фиброзной сетки из адвенти-ции и внутренней оболочки, которая служит каркасом для формирования сосуда в организме реципиента.
Имплантация больным 120 артериальных трансплантататов из бычьей сонной артерии, обработанных по методике Rosenberg и соавторов (1964), показала, что их можно использовать для замещения артерий человека (Keshishian и соавт., 1971). Эти трансплантаты иммунологически совместимы с тканями человека, имеют отрицательный электрический потенциал, что уменьшает опасность тромбоза, могут сохраняться продолжительное время в консервирующей среде.
Авторы использовали трансплантат как заплату на артерию, для замещения и обходного шунтирования, в том числе для подмышечно-бедренного шунтирования. Продолжительность функционирования трансплантатов не установлена. По мнению авторов, она соответствует длительности функционирования дакроновых протезов или аутовенозных трансплантатов.
Недостаточное количество наблюдений не позволяет сделать окончательные выводы о возможности более широкого практического использования гетеро- и гомотрансплантатов для реконструкции сосудов у человека. Необходимы дальнейшие исследования.
Пластика сосудов с использованием синтетических трансплантатов нашла практическое применение в клинике -в 50-е годы, когда были предложены пористые синтетические пластмассовые сосудистые протезы из виньона (Voorhees, Jaretski, Blakemore, 1952). Однако этот вопрос имеет давнюю историю. Abbe в 1894 г. заменил артерию у собаки стеклянной трубкой. В первой половине нашего столетия были применены в эксперименте для замены сосудов трубки из различных материалов — резины, серебра, стекла, алюминия, слоновой кости, плексигласа, полиэтилена (Ф. Б. Балюзек, 1955; В. С. Крылов, 1956; Д. Д. Венедиктов, 1961; Carrel, 1912; Tuffier, 1915, 1917; Hufnagel, 1955, и др.).
Ригидные монолитные трубки оказались непригод
Дата добавления: 2015-07-18; просмотров: 3409;
