Добування основних солей
· Неповнезаміщення багатокислотних основ:
Аl(ОН)3 + НСl = Аl(ОН)2С1 + Н2О
Аl(ОН)3 + 2НС1 = Аl(ОН)С12 + 2Н2О
Взаємоперетворення середніх та кислих солей
· Щоб середню сіль перетворити на кислу, треба додати таку ж саму кислоту:
Na2SO4 + H2SO4 = 2NaHSO4
· Щоб кислу сіль перетворити на середню, треба додати такий самий луг:
NaHSO4 + NaOH = Na2SO4 + H2O
Комплексні сполуки
· це складні речовини, які утворюються шляхом приєднання до іону метала нейтральних молекул або протилежно заряджених іонів.
Будову КС пояснює теорія Вернера(Альфред Вернер – швейцарський хімік, лауреат Нобелевської премії за свою теорію).
[Cu(NH3)4]SO4

 КС
КС
внутрішня сфера зовнішня сфера




 NH3 2+
NH3 2+
 |

 NH3 Cu2+NH3 SO42–
NH3 Cu2+NH3 SO42–
 |  |  | |||

 NH3
NH3
лігандикомплексоутворювач
Згідно з теорією Вернера в молекулі КС позитивно заряджений іон (Cu2+) займає центральне місце і називається центральним іоном або комплексоутворювачем.Навколо нього розташовані нейтральні молекули (NH3) або негативно заряджені іони – ліганди. Комплексоутворювач та ліганди разом утворюютьвнутрішню сферуКС. Інші іони, які не розташовані у внутрішній сфері і знаходяться на більш далекій відстані від центрального іона, утворюють зовнішню сферу.
Комплексоутворювачами можуть бути атоми практично всіх елементи періодичної системи Д.І.Менделєєва. Однак лужні та лужноземельні метали утворюють дуже нестійкі комплекси. Необхідною умовою комплексоутворювача є наявність вільних орбіталей. Тому найбільш типовими комплексоутворювачами є d– і f–елементи:
Ag+, Au+, Au3+, Cu2+, Hg2+, Zn2+, Ni2+, Fe2+, Fe3+, Cr3+, Co3+, Pt4+
S– i p–елементи також здатні бути комплексоутворювачами:
– елементи-метали Be2+, Mg2+, Pb2+, Al3+, Sn2+, Sn4+
– елементи-неметали B3+, Si4+, P5+
Лігандами можуть бути нейтральні молекули або негативно заряджені групи. Необхідною вимогою до лігандів є наявність у їх складі хоча б одного атома з неподіленими електронними парами:
:NH3 H2O: :OH–
Назви лігандів
| Ліганди | Назва | Ліганди | Назва | Ліганди | Назва | Ліганди | Назва |
| Cl– F– Br– I– S2– | хлоро фторо бромо йодо тіо | OH– CN– SCN– NO2– | гідроксо ціано тіоціанато нітро | NO3– CO32– SO42– PO43– S2O32– С2O42– | нітрато карбонато сульфато фосфато тіосульфато оксалато | H2O0 NH30 CO0 NO0 | аква амін карбоніл нітрозил |
Координаційне число –це число, яке показує скільки лігандів знаходиться навколо комплексоутворювача. Число лігандів кожного виду вказують числовими префіксами:
2 – ди 6 – гекса
3 – три 7 – гепта
4 – тетра 8 – окта
5 – пента
Згідно з емпіричним правилом Вернера координаційне число комплексоутворювача часто в 2 рази більше, ніж абсолютне значення його заряду:
| Заряд комплексоутворювача | Характерне координаційне число |
| +1 +2 +3 +4 |
Комплексна частинка (внутрішня сфера) може бути:
· катіоном [Cu(NH3)4]2+
· аніоном [Fe(CN)6]4–
· молекулою [Fe(SCN)3]0
Номенклатура КС
· Комплексний катіон
| укр. назва Число лігандів – їх назва – комплексоутворювача зовнішня сфера |
[Cu(NH3)4]SO4 – тетраамінкупрум(ІІ) сульфат
[Ag(NH3)2]Cl – диамінаргентум хлорид
· Комплексний аніон
 корінь латин. назви
Зовнішня сфера число лігандів – їх назва – комплексоутворювача + ат корінь латин. назви
Зовнішня сфера число лігандів – їх назва – комплексоутворювача + ат
|
K3[Fe(CN)6] – калій гексаціаноферат(ІІІ)
K4[Fe(CN)6] – калій гексаціаноферат(ІІ)
Na[Al(OH)4] – натрій тетрагідроксоалюмінат
Na2[Zn(OH)6] – натрій гексагідроксоцинкат
· Комплексна молекула
| укр. назва Число лігандів – їх назва – комплексоутворювача |
[Pt(NH3)2Br2] – диаміндибромплатина
Деякі комплексні сполуки мають спеціальні назви:
K3[Fe(CN)6] – червона кров’яна сіль
K4[Fe(CN)6] – жовта кров’яна сіль
Класифікація КС
· Комплексні кислоти: H2[SiF6] – гідроген гексафторосилікат
H[AuCl4] – гідроген тетрахлороаурат
· Комплексні основи: [Ag(NH3)2]OH –диамінаргентум гідроксид
[Cu(NH3)4](OH)2 – тетраамінкупрумгідроксид
· Комплексні солі: K3[Fe(CN)6]–калійгексаціаноферат(ІІІ)
K2[PtCl6] – калій гексахлороплатинат
Природа хімічних зв’язків у КС
· між зовнішньою та внутрішньою сферами – іонний зв’язок;
· між комплексоутворювачем та лігандами – донорно-акцепторний (координаційний) зв’язок.
| |
| |
| |
|
 Cu0 1s22s22p63s23p63d104s1
Cu0 1s22s22p63s23p63d104s1
| |  |
 Cu2+ 1s22s22p63s23p63d94s0
Cu2+ 1s22s22p63s23p63d94s0

 NH3
NH3
|

 2+ H3N NH3 2+
2+ H3N NH3 2+
|


|
 Cu2+ + 4 :NH3 H3N Cu2+ NH3 Cu
Cu2+ + 4 :NH3 H3N Cu2+ NH3 Cu
|



NH3 H3N NH3
Cu2+ – акцептор
:NH3 – донор
Дисоціація КС
І ступінь –дисоціація на зовнішню та внутрішню сфери(повністю – сильний електроліт):
[Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42–
ІІ ступінь –дисоціація комплексного іона (не повністю – слабкий електроліт):
[Cu(NH3)4]2+ ↔ Cu2+ + 4NH30
Міцність комплексного іона визначається значенням константи нестійкості:
[Cu2+]∙[NH3]4
Кдис = –––––––––––– або Кнест
[Cu(NH3)4]2+
Чим менше значення Кнест, тим стійкіший комплекс.
Внутрішньокомплексні сполуки
При взаємодії катіонів комплексоутворювачей з деякими органічними лігандами утворюються внутрішньокомплексні сполуки. В них комплексоутворювач зв’язаний лігандами і ковалентним, і донорно-акцепторним зв’язком. Наприклад, купрум гліцерат:
CH2 – OH HO – CH2
׀ H ׀
 CH – O O – CH
CH – O O – CH

 ׀ Cu2+ ׀
׀ Cu2+ ׀
CH2 – O O – CH2
H
До внутрішньокомплексних сполук відносять природні комплекси гемоглобін, хлорофіл та вітамін В12.
Гемоглобін – складний білок, що складається з білка глобіна та забарвленої у червоний колір небілкової частини – гема. За хімічною будовою гем є комплексом порфірину з Fe2+. Гемоглобін в організмі виконує роль переносника кисню з легенів у тканини. Молекула кисню зворотно реагує з гемоглобіном з утворенням оксигемоглобіну.
 |




 НС СН
НС СН


 N
N



 N Fe2+ N
N Fe2+ N







 N
N


 НС СН
НС СН
 |
Деякі речовини (чадний газ СО та ціаніди) утворюють з гемоглобіном більш стійкі комплекси, ніж кисень, і таким чином блокують дію гемоглобіну. Такі сполуки відносяться до дихальних отрут.
Хлорофіл – це комплекс порфірину з Mg2+. Хлорофіл відіграє важливу роль в процесі фотосинтезу, перетворюючи світлову енергію сонячних променів на енергію хімічних зв'язків.
Вітамін В12 (ціанокобаламін)– це комплекс порфірину з Со3+. Він необхідний для нормального кровотворення.
При взаємодії динатрієвої солі етилендиамінтетраацетатної кислоти, яку називають комплексон ІІІ або трилон Б, з іонами металів також утворюються внутрішньокомплексні сполуки:
 CH2COONa
CH2COONa

 СН2 ─ N
СН2 ─ N
 CH2COOH
CH2COOH
 CH2COOH трилон Б
CH2COOH трилон Б

 СН2 ─ N
СН2 ─ N
CH2COONa
 CH2COONa
CH2COONa


 СН2 ─ N
СН2 ─ N

 CH2COO внутрішньокомплексна сполука
CH2COO внутрішньокомплексна сполука
 Ca2+
Ca2+
 CH2COO
CH2COO

 СН2 ─N
СН2 ─N
CH2COONa
Значення та використання КС
· Лікарські препарати:
Ø [Pt(NH3)2Cl2]та (NH4)2[IrCl6] – мають протипухлинну дію;
Ø комплекси Ауруму з α-тіоспиртами використовують для лікування туберкульозу та прокази;
Ø комплекс хлориду кобальту (ІІ) з амідом нікотинової кислоти (препарат коамід) використовують для лікування анемії, закритих переломів, злоякісних пухлин;
Ø комплекс Феруму (ІІ) з амідом нікотинової кислоти (препарат ферамід) використовують для підвищення вмісту Феруму в організмі.
· Якісний аналіз:
Ø для відкриття окремих іонів
K3[Fe(CN)6] – червона кров’яна сіль
K4[Fe(CN)6] – жовта кров’яна сіль
3Fe2+ + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2↓ + 6K+ синій осад
3Zn2+ + 2K3[Fe(CN)6] = Zn3[Fe(CN)6]2↓ + 6K+ жовто-коричневий осад
4Fe3+ + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3↓ + 12K+ синій осад
2Zn2+ + K4[Fe(CN)6] = Zn2[Fe(CN)6]↓ + 4K+ білий осад
2Cu2+ + K4[Fe(CN)6] = Cu2[Fe(CN)6]↓ + 4K+ бурий осад
Ø для розчинення осадів
AgCl↓ + 2NH3 = [Ag(NH3)2]Cl
Ø для маскування іонів –іон, що заважає відкриттю іншого іона, переводять у стійкий безбарвний комплекс. Наприклад, відкриттю Zn2+ реактивом (NH4)2[Hg(SCN)] заважають іони Fe3+, тому що утворюють з реактивом Fe(SCN)3 криваво-червоного кольору, на фоні якого білий осад сполуки Zn не видно. Іони Fe3+ зв’язують у стійкий комплекс за допомогою винної або лимонної кислоти.
· Кількісний аналіз сполук, що містять іони металів
 CH2COONa CH2COONa
CH2COONa CH2COONa

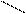

 СН2 – N CH2 – N
СН2 – N CH2 – N
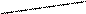

 CH2COOH CH2COO
CH2COOH CH2COO
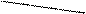 +Ca2+ = Ca2+ + 2H+
+Ca2+ = Ca2+ + 2H+

 CH2COOH CH2COO
CH2COOH CH2COO

 СН2 – N CH2 – N
СН2 – N CH2 – N
CH2COONa CH2COONa
Дата добавления: 2015-08-26; просмотров: 1264;
