Номенклатура кислот
| Формула | Стара назва | Нова назва | Сила кислоти |
| HF | плавикова | фторидна | середня |
| HCl | соляна | хлоридна | сильна |
| HBr | бромоводнева | бромідна | сильна |
| HI | йодоводнева | йодидна | сильна |
| H2S | сірководнева | сульфідна | слабка |
| HCN | синильна | ціанідна | дуже слабка |
| H2SO4 | сірчана | сульфатна | сильна |
| H2SO3 | сірчиста | сульфітна | середня |
| H2S2O3 | тіосірчана | тіосульфатна | сильна |
| HNO3 | азотна | нітратна | сильна |
| HNO2 | азотиста | нітритна | слабка |
| HClO | хлорнуватиста | гіпохлоритна | слабка |
| HClO2 | хлориста | хлоритна | середня |
| HClO3 | хлорнувата | хлоратна | сильна |
| HClO4 | хлорна | перхлоратна | сильна |
| H3PO4 | ортофосфорна | ортофосфатна | середня |
| HPO3 | метафосфорна | метафосфатна | середня |
| H4P2O7 | пірофосфорна | дифосфатна | середня |
| Н3РО3 | фосфориста | фосфітна | середня |
| H3BO3 | ортоборна | ортоборатна | дуже слабка |
| HBO2 | метаборна | метаборатна | дуже слабка |
| H2B4O7 | тетраборна | тетраборатна | середня |
| H2CrO4 | хромова | хроматна | сильна |
| H2Cr2O7 | дихромова | дихроматна | сильна |
| HMnO4 | марганцева | перманганатна | сильна |
| H2MnO4 | марганцевіста | манганатна | середня |
| H2CO3 | вугільна | карбонатна | слабка |
| H2SiO3 | кремнієва | силікатна | дуже слабка |
| HAlO2 | метаалюмінієва | метаалюмінатна | дуже слабка |
| H2ZnO2 | цинкова | цинкатна | слабка |
Солі
· це складні речовини, що складаються з атомів металів та кислотних залишків.
Класифікація солей
1. Середні солі складаються тільки з атомів металів та кислотних залишків:
NaCl – натрій хлорид
Na2CО3– натрій карбонат
2. Кислі солі – між атомом металу та кислотним залишком міститься 1-2 атома Н:
NaHCО3– натрій гідрогенкарбонат
Na2HPO4 – натрій гідрогенфосфат
NaH2PО4– натрій дигідрогенфосфат
Кислі солі можуть бути утворені тільки багатоосновними кислотами:
+ – 2+ – 3+ –
H2SO4 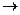 NaHSO4, Ca(HSO4)2, Al(HSO4)3
NaHSO4, Ca(HSO4)2, Al(HSO4)3
+ 2– 2+ 2– 3+ 2–
H3PO4 → Na2HPO4, CaHPO4, Al2(HPO4)3
+ – 2+ – 3+ –
NaH2PO4, Ca(H2PO4)2, Al(H2PO4)3
3. Основні солі – між атомом металу та кислотним залишком міститься 1-2 групи ОН:
Mg(OH)Cl– магній гідроксохлорид
А1(ОН)Сl2 – алюміній гідроксохлорид
А1(ОН)2Сl– алюміній дигідроксохлорид
Основні солі можуть бути утворені тільки багатокислотними основами.
4. Подвійні солі:
NaKCO3 – натрій-калій карбонат
KA1(SO4)2– калій-алюміній сульфат
5. Змішані солі:
Ca(ClO)Cl – кальцій хлорид-гіпохлорит
6. Комплексні солі:
К3[Fe(СN)6] – калій гексацианоферат (III)
K4[Fe(CN)6] – калій гексацианоферат(II)
[Ag(NH3)2]C1– діамінагрентум хлорид
Хімічні властивості середніх солей
|
|
Хімічні властивості кислих солей
|
|
Дата добавления: 2015-08-26; просмотров: 807;
