P p p-p
σ – зв’язокутворюється при перекриванні орбіталей вздовж лінії, що з’єднує центри атомів: σss , σsp , σpp
π – зв’язокутворюється при бічному перекриванні орбіталей: πpp
Донорно-акцепторний механізм:

|
· Донор –частинка, що надає пару електронів.
· Акцептор – частинка з вільною орбіталлю.
Кратність зв’язку – це кількість спільних електронних пар між атомами.
 Н2 H – H H : H 1H 1s1
Н2 H – H H : H 1H 1s1









 O2 O = O O :: O 8O 1s22s22p4
O2 O = O O :: O 8O 1s22s22p4








 N2 N ≡ N N ׃׃׃ N 7N 1s22s22p3
N2 N ≡ N N ׃׃׃ N 7N 1s22s22p3
Одинарний зв’язок– σ – зв’язок.
Подвійний зв’язок– 1σ + 1π.
Потрійний зв’язок– 1σ + 2π.
Енергія зв’язку – це енергія, що необхідна для розриву зв’язку. Зі збільшенням радіуса атома енергія зменшується:
HF Е = 536 кДж/моль
HCl Е = 432 кДж/моль
HBr Е = 360 кДж/моль
HIЕ = 299 кДж/моль
Зі збільшенням кратності зв’язку енергія збільшується:
С – С Е = 356 кДж/моль
С = С Е = 592 кДж/моль
С ≡ С Е = 813 кДж/моль
Довжина зв’язку – це відстань між центрами атомів у молекулі. Чим більша довжина, тим менше міцність зв’язку:
С – С ℓ = 0,154 нм
С = С ℓ = 0,134 нм
С ≡ С ℓ = 0,120 нм
Валентний кут залежить від природи атомів і характеру хімічного зв’язку. В двохатомних молекулах він дорівнює 180°:
H – F, H – Cl, H – H, C = O
В багатоатомних молекулах:
H2O 104,5°
NH3 107,3°
CH4 109°28´
Полярність зв’язку:
· Неполярний ковалентний зв’язокутворюється між однаковими атомами:
H – H, O = O, N ≡ N
Спільна електронна пара розміщується симетрично між ядрами обох атомів.
· Полярний ковалентний зв’язокутворюється між атомами з різною електронегативністю: H – Cl, C = O
Спільна електронна пара зміщена до атома з більшою електронегативністю.
Іонний зв’язок
– це хімічний зв’язок, обумовлений електростатичним притяжінням протилежно заряджених іонів:
Na – 1ē = Na+  Cl + 1ē = Cl–
Cl + 1ē = Cl–
Na+ + Cl– = NaCl
Іони – це заряджені частинки.
Катіони – позитивно заряджені іони.
Аніони – негативно заряджені іони.
Іонний зв’язок є крайнім випадком ковалентного полярного зв’язку, коли спільна електронна пара повністю переходить до більш електронегативного атома.
Типи кристалічних ґраток
· Іонні –мають високі температури плавлення та кипіння, в розчині розпадаються на іони, в рідкому стані електропровідні (солі, тверді луги).
· Молекулярні –леткі, мають низьку твердість, невисокі температури плавлення та кипіння (H2O, NH3, CO2, I2, Р4, S8 – в твердому стані).
· Атомні –міцні, нерозчинні, мають високі температури плавлення та кипіння (алмаз, кремній, графіт).
· Металічні –пластичні, електро- та теплопровідні (метали та їх сплави).
Міжмолекулярна взаємодія
При зближенні молекул між ними діють сили притягування та відштовхування – сили ван-дер-ваальса.
· Орієнтаційна взаємодіявиникає між полярними молекулами:
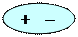
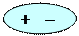

· Індукційна взаємодія виникає між полярною та неполярною молекулами. Під дією полярної молекули відбувається деформація неполярної, в ній виникає диполь.
Водневий зв’язок
Гідроген, який утворив ковалентний зв’язок з атомом Х, часто може утворити додатковий хімічний зв’язок з іншим більш електронегативним атомом У. Такий зв’язок називають водневимі позначають Х – Н ... У. За міцністю водневий зв’язок перевищує ван-дер-ваальсовські сили, але слабший за ковалентний зв’язок:


 Н – О ... Н – О ... Н – О
Н – О ... Н – О ... Н – О



 Н Н Н
Н Н Н
Водневий зв’язок суттєво впливає на властивості речовин:
· речовини Н2О та НF за звичайних умов рідкі, в той час як їх аналоги газоподібні;
· речовини НСl, NH3, C2H5OH здатні утворювати водневі зв’язки з молекулами води і це є причиною їх високої розчинності;
· водневі зв’язки впливають на швидкість хімічної реакції. Чим більше їх у вихідних речовинах, тим важче перебігає реакція.
Водневі зв’язки можуть бути міжмолекулярними та внутрішньо молекулярними. У другому випадку він утворюється між двома функціональними групами:

HN – CH2 – C – OH
׀ ׀׀
Н . . . . . . . О
Валентність та ступінь окиснення
Валентність –це здатність атома утворювати хімічні зв’язки з атомами таких самих або інших елементів:
Н – Н Н – Сl Н – О Н – N – Н О = О С = О N ≡ N
׀ ׀
Н Н
Ступінь окиснення –це умовний заряд атома в молекулі (дорівнює кількості полярних валентностей):
+1 –1 +2 –2 0 0 0 0 0 0 +1 –1 –1 +1


 Н Сl С О Н – Н О = О N ≡ N Н С ≡ С Н
Н Сl С О Н – Н О = О N ≡ N Н С ≡ С Н
+1 0 +1
 Н С Н
Н С Н

О –2
Оксиди
· це складні речовини, що складаються з двох елементів, один з яких Оксиген. В оксидах атоми Оксигену хімічно пов’язані з атомами інших елементів, але не утворюють зв’язків між собою. В оксидах ступінь окиснення Оксигену –2.
Загальні формули вищих оксидів наведені у таблиці Д.І.Менделєєва.
Класифікація оксидів
 |
 солетворні оксиди несолетворні оксиди
солетворні оксиди несолетворні оксиди
основніH2O, CO, N2O, NO
кислотні (не виявляють ні основних, ні кислотних
амфотерні властивостей, тобто не утворюють солей)
Основні оксиди– це оксиди металів, їм відповідають основи:
Na2O → NaOH
СаО → Са(ОН)2
Кислотні оксиди– це оксиди неметалів та металів з високою валентністю (IV, V; VI; VII), їм відповідають кислоти:
СО2 → H2CO3 V2O5 → HVO3
SO2 → H2SO3 CrO3 → H2CrO4
SO3 → H2SO4 Mn2O7 → HMnO4
N2O5 → HNO3
Амфотерні оксиди –це оксиди амфотерних металів Zn, Al, Cr, їм відповідають й основи, й кислоти:


 Zn(OH)2 Al(OH)3 Cr(OH)3
Zn(OH)2 Al(OH)3 Cr(OH)3


 ZnO Al2O3 Cr2O3
ZnO Al2O3 Cr2O3
H2ZnO2 HAlO2 HCrO2
Хімічні властивості основних оксидів
|
| ||||
Хімічні властивості кислотних оксидів
|
| ||||
Хімічні властивості амфотерних оксидів
|
|
Добування оксидів
1. Проста речовина + кисень: С + О2 → СО2
S + O2 → SO2
4P + 5O2 → 2P2O5
N2 + O2 → 2NO
2Мg + О2 → 2МgО
2. Розклад нерозчинних основ: Fe(OH)2 → FeO + H2O
2Fe(OH)3 → Fe2O3 + 3H2O
3. Розклад деяких кислот: Н2СО3 → СО2 + Н2О
Н2SО3 → SО2 + Н2О
Н2SіО3 → SіО2 + Н2О
4. Розклад деяких солей: СаСО3 → СаО + СО2
СаSО3 → СаО + SО2
Дата добавления: 2015-08-26; просмотров: 701;
