Електронна оболонка
Енергетичні рівні– їх число дорівнює номеру періоду:
С +6 )) Al +13 ))) Ca +20 ))))


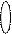 Підрівні– відрізняються формою орбіталей:
Підрівні– відрізняються формою орбіталей:
 |

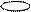
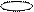
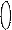



 s – p – d f
s – p – d f
| рівні | підрівні |
| s sp spd spdf spdf spdf spdf |
Орбіталі– відрізняються напрямком у просторі:
| підрівні | орбіталі |
| s p d f |   1 1
   3 3
     5 5
       7 7
|
Спін– обертання електрона навколо власної осі.
Електрони з паралельними спінами– обертаються в одному напрямку,
відштовхуються, не можуть знаходитися на одній орбіталі.
Електрони з антипаралельними спінами– обертаються в протилежних
напрямках, притягуються, можуть знаходитися на одній орбіталі.
| ↑↓ |
| ↑ |
Порядок заповнення електронами рівнів та підрівнів
| Рівні | Порядок заповнення |
| 1s2 2s22p6 3s23p6 4s23d104p6 5s24d105p6 6s24f145d106p6 7s25f146d107p6 |
На зовнішньому рівні не може бути більше 8 електронів. Такий рівень вважається завершеним.
· Порядковий номер елементадорівнює заряду ядра (кількості протонів) та загальній кількості електронів.
· Номер періоду дорівнює числу енергетичних рівнів.
· Номер групи дорівнює:
– для головних підгруп – числу електронів на зовнішньому рівні. Це валентні електрони, вони беруть участь у хімічній взаємодії.
– для побічних підгруп – числу валентних електронів, але розміщуються вони як на зовнішньому, так і на передостанньому рівні.
Квантові числа
– характеризують стан електронів у атомі.
· Головне квантове число n– характеризує енергію електрона (1 – 7).
· Побічне (орбітальне) квантове число ℓ –характеризує форму орбіталі:
s – 0, p – 1, d – 2, f – 3.
· Магнітне квантове число m – характеризує орієнтацію орбіталі у просторі відносно напрямку зовнішнього магнітного поля (–ℓ, 0, +ℓ).
| ℓ | m |
| –1, 0,+1 –2,–1, 0,+1,+2 –3,–2,–1, 0,+1,+2,+3 |
· Спінове квантове число s –характеризує обертання електрона навколо власної осі в той чи інший бік (+½, –½).
| Рівні | Підрівні | Орбіталі | ||
| числове значення | n | тип орбіталі | ℓ | m |
| s | ||||
| s p | –1, 0,+1 | |||
| s p d | –1, 0,+1 –2,–1, 0,+1,+2 | |||
| s p d f | –1, 0,+1 –2,–1, 0,+1,+2 –3,–2,–1, 0,+1,+2,+3 |
Правила, які визначають порядок заповнення атомних орбіталей
· Принцип найменшої енергії:заповнення електронами атомних орбіталей відбувається у порядку збільшення їх енергій.
· Перше правило Клечковського:заповнення електронами енергетичних підрівнів відбувається у порядку послідовного збільшення суми головного та орбітального квантових чисел n +ℓ .
· Друге правило Клечковського:із двох атомних орбіталей з однаковою сумою n +ℓпершою заповнюється орбіталь з меншим значенням головного квантового числа.
| Підрівень | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p |
| Сума n + l | 3+0=3 | 3+1=4 | 3+2=5 | 4+0=4 | 4+1=5 | 4+2=6 | 4+3=7 | 5+0=5 | 5+1=6 |
| Порядок заповнення |
· Принцип Паулі:в атомі не може бути двох електронів, у яких всі чотири
квантові числа однакові.
· Правило Хунда:на кожну атомну орбіталь підрівня спочатку поступає по
одному електрону з однаковим напрямком спіну.
· Правило симетрії:електронна конфігурація повністю та наполовину заповнених підрівнів має високу енергетичну стійкість, тому такі конфігурації більш імовірні, ніж незавершені підрівні.
|
| |
|
|
|
|
Утворення симетричних конфігурацій можливе за рахунок проскоку електрона з одного енергетичного рівня на інший.
|
|
|
|
|
|
Періодичний закон Д.І.Менделєєва
| Властивості хімічних елементів та їх сполук знаходяться у періодичній залежності від заряду ядра. |
· Металічність– це здатність елемента віддавати валентні електрони:
Na0 – 1ē → Na+
Mg0 – 2ē → Mg2+
Al0 – 3ē → Al 3+
Чим менше електронів в атомі на зовнішньому рівні, тим активніший метал. Тобто, по періоду металічні властивості елементів зменшуються.
· Неметалічність – це здатність елемента приймати на свій зовнішній рівень електрони до його завершення (до 8):
Si0 + 4ē → Si4–
P0 + 3ē → P3–
S0 + 2ē → S2–
Cl0 + 1ē → Cl–
Чим більше електронів в атомі на зовнішньому рівні, тим активніший неметал. Тобто, по періоду неметалічні властивості елементів зростають.
Неметали можуть також віддавати електрони більш активним неметалам:
Si0 – 4ē → Si4+
P0 – 5ē → P5+
S0 – 6ē → S6+ О0 + 2ē → О2–
Cl0 – 7ē → Cl7+
· Період –це горизонтальний ряд елементів, розташованих за зростанням заряду ядра. Період об’єднує елементи з однаковою кількістю енергетичних рівнів. По періоду металічні властивості елементів зменшуються, а неметалічні зростають, тому що зростає кількість електронів на зовнішньому рівні.
ü Малі періодимістять s– і p–елементи, у яких заповнюються електронами зовнішні рівні. Це елементи головних підгруп:
Na 3s1 Mg3s2 Al3s23p1 Si 3s23p2 …
ü Великі періодиміж s– і p–елементами містять по 10 d–елементів, у яких заповнюється передзовнішний d–підрівень, а на зовнішньому рівні залишається 1 чи 2 s–електрони. Це елементи побічних підгруп (перехідні елементи), їх властивості зі збільшенням заряду ядра змінюються незначно.
K4s1 Ca4s2 Sc4s23d1 Ti4s23d2 …
Zn4s23d10 Ga4s23d104p1 …
ü Лантаноїди та актиноїди– це f–елементи, у яких заповнюється електронами f–підрівень третього зовні енергетичного рівня, а на зовнішньому рівні містяться 2 s–електрони. По 14 f–елементів знаходяться між s– і d–елементами у шостому і сьомому періодах.
· Група – це вертикальний ряд елементів з однаковим числом валентних електронів та однаковим вищим ступенем окислення, що дорівнює номеру групи. По групі зверху вниз металічні властивості зростають, а неметалічні зменшуються, тому що зростає радіус атома.
| Головна підгрупа | Побічна підгрупа |
| s– та p–елементи | d–елементи |
| кількість електронів на зовнішньому рівні дорівнює номеру групи | 1 або 2 електрони |
| метали та неметали | тільки метали |
| кількість валентних електронів дорівнює номеру групи | кількість валентних електронів дорівнює номеру групи |
| вищий ступінь окиснення дорівнює номеру групи | вищий ступінь окиснення дорівнює номеру групи |
Групи головних елементів:
І група – лужні метали: Літій, Натрій, Калій, Рубідій, Цезій, Францій.
ІІ група – Берилій, Магній та лужноземельні метали: Кальцій, Стронцій, Барій, Радій.
VІ група – халькогени: Оксиген, Сульфур, Селен, Телур, Полоній.
VІІ група – галогени:Флуор, Хлор, Бром, Йод, Астат.
VІІІ група – інертні гази:Гелій, Неон, Аргон, Криптон, Ксенон, Радон.
· Енергія іонізації І –це енергія, що необхідна для відриву електрона від незбудженого атома.Чим менше електронів на зовнішньому рівні та більше радіус атома, тим менше енергія іонізації. Тобто у металів енергія іонізації мала.
· Спорідненість до електрона Е –цеенергія, яка виділяється при приєднанні електрона до незбудженого атома. Чим більше електронів на зовнішньому рівні та менше радіус атома, тим більше спорідненість до електрона. Тобто у неметалів енергія спорідненості до електрону велика.
· Електронегативність χ –це здатність атома притягувати до себе спільну електронну пару в хімічній сполуці:
χ = І + Е
Найбільш електронегативний елемент Флуор ( χ = 4,10 ) – неметал.
Найменш електронегативний елемент Францій( χ = 0,86 ) – метал.
Зростання неметалічних (окисних) властивостей
(електронегативності, енергії спорідненості)
 |

| I | II | III | IV | V | VI | VII |
Зростанняметалічних
(відновних) властивостей
(зменшення енергії
іонізації та
електронегативності)
В цьому варіанті періодичної системи указані тільки неметали.
| I | II | III | IV | V | VI | VII | VIII | |
| H | He | |||||||
| B | C | N | O | F | Ne | |||
| Si | P | S | Cl | Ar | ||||
| As | Se | Br | Kr | |||||
| Te | I | Xe | ||||||
| At | Rn | |||||||
Хімічні зв’язки
– це всі види взаємодії між атомами, які забезпечують існування двох- та багатоатомних сполук.
· Внутришньомолекулярні зв’язки:
ü ковалентний
ü іонний
ü металічний
· Міжмолекулярні зв’язки:
ü водневий
ü ван–дер–ваальсова взаємодія
Ковалентний зв’язок
– це хімічний зв’язок, що виникає за рахунок утворення спільної електронної пари. Існує два механізми утворення ковалентного зв’язку. В одному випадку кожний з двох атомів, що утворює зв'язок, надає для цього по одному неспареному електрону. В другому випадку один атом надає неподілену пару електронів, а другий – вільну орбіталь.




Обмінний механізм:







 + → + →
+ → + →
Дата добавления: 2015-08-26; просмотров: 2193;
