Водневий показник.
Чиста вода дуже погано проводить електричний струм, але частково вона дисоціює – слабкий електроліт:
H2O ↔ H+ + ОН–
[H+] ∙ [OH–]
Константа дисоціації: Кдис = ––––––––––– = 1,8 ∙10 –16 (t°=22°С)
[H2O]
Кдис була виміряна методом електропровідності.
Рівноважну концентрацію води можна вважати сталою величиною [H2O] = const, яка дорівнює її молярній концентрації:
[H2O] = 1000:18=55,56 моль/л
Тоді рівняння має вигляд: КH2O = Кдис∙[H2O] = [H+] ∙ [OH–]
1,8 ∙10 –16 ∙55,56 = [H+] ∙ [OH–] = 1∙10–14
КH2O – стала при даній температурі величина, яку називають іонним добутком води.Із зміною температури К H2O також змінюється:
t°=22°С К H2O = 1∙10–14
t°=30°С К H2O = 1,89∙10–14
t°=50°С К H2O = 5,6∙10–14
t°=100°С К H2O = 74∙10–14
|
Як би не змінювалася концентрація [H+] чи [OH–], їх добуток залишається сталою величиною при певній температурі у будь-якому водному розчині.
· [H+] ∙ [OH–] = 10–14, тобто [H+] ∙ [OH–] ≠ 0, тому [H+] ≠ 0 та [OH–] ≠ 0
Тобто в розчині завжди присутні як H+, так і OH– незалежно від середовища.
· [H+]∙[OH–]=const, тому зміна [H+] призводить до зміни [OH–] (наприклад, ↓[H+] супроводжується ↑[OH–] )
В чистій воді: [H+] = [OH–] = √ 10–14 = 10–7 – нейтральне середовище.
В кислому середовищі: [H+] > [OH–]; [H+] >10–7; [OH–] < 10–7 – кисле середовище.
В лужному середовищі: [H+] < [OH–]; [H+] < 10–7; [OH–] >10–7 – лужне середовище.
рН = – ℓg [H+] – водневий показник
рOН = – ℓg [OH–] – гідроксильний показник

[H+] ∙ [OH–] = 10–14 прологарифмуємо: ℓg [H+] + ℓg [OH–] = –14
–ℓg [H+] – ℓg [OH–] = 14

рН ‹ 7 – кислий розчин
|
рН › 7 – лужний розчин
Шкала кислотності (зміна кольору універсального індикаторного паперу):
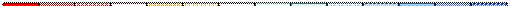
Гідроліз солей
Гідроліз –це реакція обміну між речовиною і водою, в результаті якої утворюється слабкий електроліт:
АВ + НОН → АОН + НВ
Гідролізу піддаються хімічні сполуки, які належать до різних класів: солі, бінарні сполуки, ефіри, жири, вуглеводи, білки тощо. У неорганічній хімії найчастіше вивчають гідроліз солей.
Будь-яку сіль можна представити, як продукт взаємодії основи та кислоти. Основи та кислоти бувають сильні та слабкі.
Fe(OH)3 NaOH

 FeCl3 Na2SO4
FeCl3 Na2SO4
HCl H2SO4
Солі, утворені сильною основою та сильною кислотою, гідролізу не піддаються, тому що в результаті обмінної реакції з водою не утворюється слабкий електроліт.
Гідролізу піддаються солі, які утворені:
· слабкою основою та сильною кислотою;
· сильною основою та слабкою кислотою;
· слабкою основою та слабкою кислотою.
Слабкі основи: –всі нерозчинні
– розчинна NH4OH
Слабкі кислоти:H2CO3 , H2SO3 , H2SiO3 , H3PO4 , HNO2 , H2S , HF , CH3COOH
Гідроліз за катіоном –це гідроліз солі, утвореної слабкою основою та сильною кислотою.
NH4OH – слабка основа
NH4Cl ––––––– NH4Cl ↔ NH4+ + Cl–
HCl – сильна кислота
NH4+ + HOH ↔ NH4OH+ H+ іонне рівняння гідролізу
NH4Cl + HOH ↔ NH4OH+ HClмолекулярне рівняння гідролізу
рН < 7 (кисле середовище)
На практиці часто зустрічається гідроліз солей, які містять багатозарядний катіон слабкої основи. В цьому випадку гідроліз йде ступінчасто: на першому ступені утворюється основна сіль, а вже на другому – слабка основа.
Fe(OH)2 – слабка основа
FeCl2 –––––––––––– FeCl2 ↔ Fe2+ + 2Cl–
HCl – сильна кислота
І ступінь: Fe2+ + HOH ↔ FeOH+ + H+
FeCl2 + HOH ↔ FeOHCl+ HCl
Гідроліз відбувається переважно за першим ступенем, тобто утворюється основна сіль. Але в дуже розбавленому розчині гідроліз може дійти до кінця.
ІІ ступінь: FeОН+ + HOH ↔ Fe(OH)2 + H+
FeOHCl + НОН ↔ Fe(OH)2 + HCl рН < 7 (кисле середовище)
Гідроліз за аніоном –це гідроліз солі, утвореної слабкою основою та сильною кислотою.
NaOH – сильна основа
CH3COONa ––––––––––– CH3COONa ↔ CH3COO–+ Na+
CH3COOH – слабка кислота
CH3COO–+ HOH ↔ CH3COOH + OH–
CH3COONa + HOH ↔ CH3COOH + NaOH рН > 7 (лужне середовище)
Солі, які містять багатозарядний аніон слабкої кислоти, гідролізуються ступінчасто: на першому ступені утворюється кисла сіль, а вже на другому – слабка кислота.
KOH – сильна основа
K2S –––––– K2S ↔ 2K+ + S2–
H2S – слабка кислота
І ступінь: S2– + HOH ↔ НS– + OH–
K2S + HOH ↔ КНS + КOH
Гідроліз відбувається переважно за першим ступенем, тобто утворюється кисла сіль. Але в дуже розбавленому розчині гідроліз може дійти до кінця.
ІІ ступінь: НS– +HOH ↔ Н2S + OH–
КНS +HOH ↔ Н2S + КOH рН › 7 (лужне середовище)
Гідроліз за катіоном та аніоном –це гідроліз солі, утвореної слабкою основою та слабкою кислотою.
NH4OH – слабка основа
CH3COONH4 –––––––––––– CH3COONH4 ↔ СН3СОО– + NH4+
CH3COOH – слабка кислота
CH3COO– + NH4+ + НОН ↔ CH3COOH + NH4OH
CH3COONH4 + НОН ↔ CH3COOH + NH4OH
Реакція середовища у розчинах таких солей залежить від співвідношення сили основи та кислоти. При їх рівній силі, як у наведеному прикладі, вона може бути нейтральною. Отже, нейтральна реакція розчину ще не свідчить про відсутність гідролізу.
|
|
Cr2S3 + 6HOH → 2Cr(OH)3↓ + 3H2S↑
Ступінь гідролізу– це величина, що показує, яка частина молекул піддалася гідролізу від загальної кількості розчинених молекул.
|
Ступінь гідролізу залежить від:
– температури;
– концентрації розчину;
– природи розчиненої речовини.
Посилити гідроліз можна:
– нагріванням розчину (гідроліз – це ендотермічний процес);
– розбавленням розчину (підвищується концентрація НОН);
– зв’язуванням продуктів гідролізу (Н+ або ОН–) в молекули слабкого електроліту (Н2О).
Для зв’язування Н+до розчину додають луг.
Для зв’язування ОН–до розчину додають кислоту.
Послабити гідроліз можна:
– охолодженням розчину;
– збільшенням концентрації солі;
– введенням в розчин одного з продуктів гідролізу:
o кислоти, якщо при гідролізі утворюється Н+
o лугу, якщо при гідролізі утворюється ОН–
Хімічні реакції
v Вид взаємодії
· Реакції розкладу – з однієї речовини утворюється дві або більше нових речовин: 2H2O = 2H2 + O2
CaCO3 = CaO + CO2
· Реакції сполучення – з двох або більше речовин утворюється одна нова речовина: C + O2 = CO2
CaO + CO2 = CaCO3
· Реакції обміну – дві складні речовини обмінюються своїми складовими частинами: NaCl + AgNO3 = AgCl + NaNO3
· Реакції заміщення – проста речовина заміщує атоми складної речовини, утворюючи нову просту й нову складну речовину:
Zn + 2HCl = ZnCl2 + H2
v Повнота протікання реакції
· Оборотні – відбуваються одночасно у протилежних напрямках:
N2 + 3H2 ↔ 2NH3
· Необоротні: осад NaCl + AgNO3 = AgCl↓ + NaNO3
газ CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
вода HCl + NaOH = NaCl + H2O
v Тепловий ефект реакції
· Екзотермічні – виділення теплоти: N2 + 3H2 ↔ 2NH3 + Q
· Ендотермічні – поглинання теплоти: N2 + O2 ↔ 2NO – Q
v Агрегатний стан реагуючих речовин
· Рідкофазні – реакції в розчинах:
NaCl + AgNO3 = AgCl + NaNO3
· Газофазні– вихідні речовини газоподібні:
N2(г) + 3H2(г) = 2NH3(г)
· Твердофазні – вихідні речовини тверді:
CaO(тв) + 3C(тв) = CaC2 + CO↑
· Гомогенні – вихідні речовини мають однаковий агрегатний стан:
CaO(тв) + 3C(тв) = CaC2 + CO↑
· Гетерогенні – вихідні речовини мають різний агрегатний стан:
С(тв) + СО2(г) = 2СО
v Зміна ступенів окиснення елементів
· Окисно-відновні – зміна ступенів окиснення:
Zn0 + 2H+1Cl = Zn+2Cl2 + H20
· Реакції без зміни ступенівокиснення:
NaCl + AgNO3 = AgCl + NaNO3
v Наявність каталізатора
кат
· Каталітичні:N2 + 3H2 → 2NH3
· Некаталітичні: NaCl + AgNO3 = AgCl + NaNO3
Окисно-відновні реакції
Ступінь окиснення –це умовний заряд атома в молекулі, якщо припустити, що всі зв’язки в ній іонні.
Правила визначення ступенів окиснення:
–1 +2
- О–2 (крім Н2О2 та ОF2)
–1 –1 –1
- Н+1 (крім МеН : NaH; CaH2)
0 0 0 0 0 0 0 0 0
- прості речовини = 0 Н2 О2 N2 F2 Cl2 Br2 I2 S Fe
- метали = заряду іона (таблиця розчинності)
Окиснення – це процес віддачі електронів, внаслідок якого ступінь окиснення елемента збільшується:
Mn+2 – 2ē = Mn+4
Відновлення – це процес приєднання електронів, внаслідок якого ступінь окиснення зменшується:
Mn+7 + 5ē = Mn+2
Окисник – це атом, молекула або іон, що приєднує електрони.
Відновник– це атом, молекула або іон, що віддає електрони.

Якщо ступінь окиснення елемента вища, то він може бути тільки окисником, який в процесі відновлення зможе знизити свій ступінь окиснення:
+7 +6 +6 +5
KMnO4, K2Cr2O7, H2SO4, HNO3
Якщо ступінь окиснення елемента нижча, то він може бути тільки відновником, який в процесі окиснення зможе підвищити свій ступінь окиснення:
–2 –3 0
H2S, NH3, метали у вільному стані
Якщо ступінь окиснення елемента проміжна, то він може бути як окисником, так і відновником:
–1 +4 +4 +4 +3
H2O2, H2SO3, SO2, MnO2, HNO2
Типи окисно-відновних реакцій:
· міжмолекулярні– окисник та відновник знаходяться в різних молекулах:
0 0 +4 –2
C + O2 = CO2
· внутрішньомолекулярні – окисник та відновник знаходяться в одній молекулі:
+1 –2 0 0
2H2O = 2H2 + O2
· диспропорціонування – один і той же елемент одночасно є й окисником, і відновником:
0 –1 +1
Cl2 + H2O = HCl + HClO
· контрдиспропорціонування– окисно-відновний розклад речовини, яка містить атоми одного елемента в різних ступенях окиснення:
–3 +5 0
NH4NO3 = N2 + 2H2O
Хімічна кінетика
– це розділ хімії, який вивчає швидкість та механізм хімічних перетворень.
Швидкість хімічної реакції –це зміна концентрації реагуючих речовин за одиницю часу.
Необхідною умовою можливості взаємодії між двома частинками (атомами, молекулами, іонами) є взаємне зіткнення, тому швидкість реакції залежить від числа зіткнень за одиницю часу.
Фактори, що впливають на швидкість реакції
· Концентрація реагуючих речовин –число зіткнень збільшується пропорційно збільшенню числа частинок в одиниці об’єму.
Закон діючих мас: швидкість хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин.
А + В = С υ = k[A] [B]
Приклади:
N2 (г) + 3H2 (г) = 2NH3 υ = k[N2] [H2]3
2NO (г) + H2 (г) = N2O + H2O υ = k[NO]2 [H2]
C (тв) + O2 (г) = CO2 υ = k[O2]
CuO (тв) + H2 (г) = Cu + H2O υ = k[H2]
Швидкість реакції не залежить від концентрації твердих речовин, тому що реакція відбувається тільки на їх поверхні.
Константа швидкості k є сталою величиною для кожної реакції (наведена в хімічних довідниках). Вона дорівнює швидкості реакції, коли концентрації дорівнюють 1 моль/л.
· Температура –при підвищенні температури зростає швидкість рухання частинок і ймовірність їх зіткнення.
Закон Вант-Гоффа: з підвищенням температури на кожні 10° швидкість гомогенної реакції збільшується в 2 – 4 рази.
 υ2 t2 – t1
υ2 t2 – t1
–– = γ 10
υ1
· Природа реагуючих речовин –далеко не кожне зіткнення призводить до хімічної взаємодії. Результативним є зіткнення між частинками, які мають деякий надлишок енергії. Такі частинки називають активними.Надлишкову енергію, яка необхідна для подолання сил відштовхування (енергетичного бар’єру), що виникають між електронними оболонками реагуючих частинок, називають енергією активації.
Кожна хімічна реакція йде через утворення проміжного комплексу, в якому старі хімічні зв’язки ще не розірвалися, а нові вже почали утворюватися:
 Н Н Н • • • • НН Н
Н Н Н • • • • НН Н

 ↔ : : → +
↔ : : → +
 І І І • • • • ІІ І
І І І • • • • ІІ І

Н2 . . . І2
|
Еакт

 Н2 + І2
Н2 + І2
∆Н 2НІ

Якщо загальний запас енергії продуктів реакції менший, ніж вихідних речовин то, реакція екзотермічна:
∆Н = Нпрод – Нвих ∆Н < 0
Для ендотермічної реакції – навпаки (∆Н > 0).
Величина енергії активації залежить від природи реагуючих речовин. Чим більша Еакт , тим важчий перебіг реакції:
1) Еакт = 0 – 80 кДж/моль – реакції миттєві:
NaCl + AgNO3 = AgCl↓ + NaNO3
2) Еакт = 80 – 120 кДж/моль – реакції повільні:
Ржавіння заліза у вологому повітрі:: 4Fe + 6H2O + 3O2 = 4Fe(OH)3
3) Еакт вище 120кДж/моль – реакції неможливі за нормальних умов:
1500°C
N2 + O2 → 2NO
Зменшити енергію активації можна підвищенням температури або введенням каталізатору.
Каталіз –це зміна швидкості реакції за допомогою додаткових речовин – каталізаторів.Дія каталізатора зводиться до зменшення енергії активації хімічної реакції.
Еакт
А + В ↔ А...В → АВ – некаталітична реакція
Еакт 1
 К + А ↔ К...А → КА
К + А ↔ К...А → КА
 Еакт 2 – каталітична реакція
Еакт 2 – каталітична реакція
КА + В ↔ К...А...В → К + АВ

 Еакт
Еакт
Еакт 2 Еакт 1 + Еакт 2 < Еакт
 Еакт 1
Еакт 1

Хімічна рівновага – це такий стан оборотної системи, коли швидкість прямої реакції дорівнює швидкості зворотної реакції. Хімічна рівновага характеризується константою рівноваги.
[C] [D]
А + В ↔ С + D Kр = ––––––
[A] [B]
Приклади:[HI]2
H2 (г) + I2 (г) ↔ 2HI (г) K = –––––––
[H2] [I2]
[NH3]2
N2 (г) + 3H2 (г) ↔ 2NH3 (г) K = –––––––––
[N2] [H2]3
[CO]2
CO2 (г) + C (тв) = 2CO (г) K = ––––––
[CO2]
[Н2О]
CuO (тв) + H2 (г) = Cu (тв) + H2O (г) К = –––––––
[Н2]
Зміщення хімічної рівноваги. Принцип Ле Шательє
Якщо на рівноважну систему спричинити будь-яку зовнішню дію, рівновага зміститься в тому напрямку, який зменшує цю дію.
· Вплив концентрації на хімічну рівновагу:
– збільшення концентрації вихідних речовин зміщує рівновагу в бік прямої реакції;
– збільшення концентрації продуктів зміщує рівновагу в бік зворотної реакції.
· Вплив температури на хімічну рівновагу:
– підвищення температури зміщує рівновагу в бік ендотермічної реакції;
– зниження температури зміщує рівновагу в бік екзотермічної реакції.
· Вплив тиску на хімічну рівновагу:
– підвищення тиску зміщує рівновагу в бік зменшення об’єму системи;
– зниження тиску зміщує рівновагу в бік зростання об’єму системи.

Галогени
Загальна характеристика:
9 F1s2 2s22p5
17Cl1s2 2s22p63s23p5
35 Br 4s24p5
53 I 5s25p5
Спільні властивості:
1.На зовнішньому рівні 7 електронів, тому вища валентність VII(крім F).
2.Мають 1 неспарений електрон, тому валентність у не збудженому стані І.
3.Можливі валентності I, III, V, VII(крім F).
4.Вищий ступінь окиснення +7 (крім F),нижчий ступінь окиснення –1.
5.Водневі сполуки: HF, HCl, HBr, HI – їх водневі розчини – кислоти.
6.Прості речовини – двохатомні: F2, Cl2, Br2, I2.
Відрізняються:
1. Fможе бути тільки одновалентним, тому що в його атомі нема вільних орбіталей і неможливе збудження.
2.Зменшується електронегативність елементів в рядуF – Cl – Br – I,тому зменшуються неметалічні властивості: F2 – Cl2 – Br2 – I2.
3.Сила кислот в рядуHF – HCl – HBr – HIзростає.
4.Розчинність солей Аргентуму в ряду AgF – AgCl – AgBr – AgI зменшується:
розчинна
сіль
5.Змінюються фізичні властивості простих речовин:
F2 – газ, що важко зріджується
С12 – газ, що легко зріджується
Вг2 – рідина
І2 – тверда речовина
Біологічна роль галогенів
Флуор –міститься в емалі зубів та кістках. Потрапляє в організм людини з
продуктами харчування (листя чаю, борошно, крупи, яйця) та питною
водою. При недостачі виникає карієс, а при надлишку – руйнування
зубної емалі.
Хлор –хлорид–іони приймають участь в утворенні буферної системи крові, у
регуляції осмотичного тиску та водно – сольового обміну,
сприяє відкладенню глікогену в печінці. Хлорид-іони входять
до складу соляної кислоти – єдиної неорганічної кислоти, яка
міститься в організмі людини. HCl відіграє важливу роль в процесі
травлення.
Бром –підсилює процеси гальмування в центральній нервовій системі.
Йод –приймає участь у синтезі гормонів щитовидної залози. При недостачі
Йоду в організмі розвивається ендемічний зоб.
Фізичні властивості:
F2 – світло-жовтий газ, з характерним запахом, з водою вступає у хімічну
реакцію. Отруйний!
С12 – жовто-зелений газ, з різким задушливим запахом, малорозчинний у воді.
Отруйний! Вдихання невеликої кількості хлору приводить до запалення і навіть до набряку легенів.
Вг2 – червоно-бура рідина, з різким подразнюючим запахом, малорозчинна у воді. Отруйна! Сильно подразнює слизові оболонки, викликає кашель, задуху. При попаданні на шкіру викликає опіки, які довго не загоюються.
І2 – чорно-сіра тверда речовина з металічним блиском, легко сублімується,
утворюючи фіолетову пару. Погано розчинна.
Хімічні властивості:
· З О2 не взаємодіють із-за близької електронегативності, але оксиди
галогенів існують.
· Взаємодія з воднем:
Н2 + F2 = 2HF – з вибухом у темряві
Н2 + С12 = 2НС1 – з вибухом при освітленні
Н2 + Вг2 = 2НВг – при нагріванні
Н2 +І2 = 2НІ – при нагріванні
· Взаємодія з металами:
2Na + F2 = 2NaF
2Na + Cl2 = 2NaCl
2Na + Br2 = 2NaBr
2Na + I2 = 2NaI
· Взаємодія з водою:
2F2+2H2O = 4HF + О2
Хлор, бром, йод спочатку розчиняються у воді, утворюючихлорну, бромну чи йодну воду, потім поступововступають у реакцію:
С12 + Н2О = НС1 + НClO
Вг2 + Н2О = НВr + НВrО
I2 + Н2О = НI + НIО
· Більш активні галогени витісняють менш активні з кислот та солей:
F2 + 2NaCl = 2NaF + Cl2
F2 + 2NaBr = 2NaF + Br2
F2 + 2NaI = 2NaF + I2
Cl2 + 2NaBr = 2NaCl + Br2
Cl2 + 2NaI = 2NaCl + I2
Br2 + 2NaI = 2NaBr + I2
Добування галогенів:
· Фтор – електроліз фторидів (розплавів): 2NaF = 2Na + F2↑
· Хлор – окисно–відновні реакції:
4НС1 + МnО2 = С12↑ + МnС12 + 2Н2О
16НС1 + 2КМnО4 = 5Сl2↑ + 2МnСl2 + 2КСl + 8Н2О
· Бром, йод – витіснення хлором з солей:
С12 + 2КІ = 2КС1 +I2
Галогeноводні
Фізичні властивості:
HF, HC1, НВr, НІ – безкольорові гази, з різким запахом, розчинні у воді, їх водні розчини – кислоти.
Хімічні властивості:
HF – слабка кислота НС1, НВr, НІ – сильні кислоти
· HCl + NaOH = NaCl + H2O
· 2НС1 + Na2O = 2NaCl + Н2О
· HCl + AgNO3 = AgCl↓ + H2O
· 2НС1 + Zn = ZnCl2 + H2↑
Специфічна властивість фторидної кислоти – роз’їдати скло:
4HF + SiO2 = SiF4 + 2H2O
Ця реакція лежить в основі травлення скла – нанесення малюнків та надписів за допомогою HF.
Якісні реакції на галогенід – іони:
Ag+ + Cl– = AgCl↓ білий осад, розчинний у розчині амоніаку.
AgCl↓ + 2NH3 = [Ag(NH3)2]Cl
Ag+ + Вr– = AgBr↓ жовтуватий осад, нерозчинний у розчині амоніаку.
Ag+ + І– = AgI↓ жовтий осад, нерозчинний у розчині амоніаку.
Оксигеновмісні сполуки галогенів
| галогени | сполуки | +1 | +3 | +5 | +7 |
 Cl2
Cl2
| оксид кислота сіль | Cl2O HClO гіпохлоритна (хлорнуватиста) NaClO гіпохлорити | Cl2O3 HClO2 хлоритна (хлориста) NaClO2 хлорити | Cl2O5 HClO3 хлоратна (хлорнуватна) NaClO3 хлорати | Cl2O7 HClO4 перхлоратна (хлорна) NaClO4 перхлорати |
| Br2 | оксид кислота сіль | Br2O HBrO гіпобромітна NaBrO гіпоброміти | Br2O3 HBrO2 бромітна NaBrO2 броміти | Br2O5 HBrO3 броматна NaBrO3 бромати | Br2O7 HBrO4 перброматна NaBrO4 пербромати |
| I2 | оксид кислота сіль | I2O HIO гіпойодитна NaIO гіпойодити | I2O3 HIO2 йодитна NaIO2 йодити | I2O5 HIO3 йодатна NaIO3 йодати | I2O7 HIO4 перйодатна NaIO4 перйодати |
посилення кислотних властивостей
HClO HСlO2 HСlO3 HСlO4
посилення окисних властивостей
Cl2 + H2O = HCl + HClO
Cl2 + 2KOH = KCl + KClO+ H2O
Гіпохлорити використовують як підбілювачі. Ефект відбілювання полягає в окисненні бруду гіпохлоритною кислотою.
3Cl2 + 6KOH = KClO3 + 5KCl + 3H2O
гарячий
 Cl
Cl
 Cl2 + Ca(OH)2 = Ca+ H2O
Cl2 + Ca(OH)2 = Ca+ H2O
OCl
хлорне вапно
При нагріванні у присутності каталізатора MnO2:
2KClO3 = 2KCl + 3O2
При нагріванні без каталізатора:
4KClO3= 3KClO4 + KCl
Перхлоратна кислота HClO4 нарівні з НІ є найсильнішою з відомих кислот. Її використовують в аналітичній хімії як неводний розчинник.
Бромати та йодати використовують в аналітичній хімії:
KBrO3 + 5KBr + 3H2SO4 = 3Br2 + 3K2SO4 + 3H2O
Вільний бром використовують для бромування органічних сполук.
Аналогічна реакція відбувається за участю йодид- та йодат-іонів:
KIO3 + 5KI + 3H2SO4 = 3I2 + 3K2SO4 + 3H2O
Застосування сполук галогенів у медицині:
· NaCl – 0,9 % розчин (ізотонічний або фізіологічний):
Ø при значних крововтратах внутришньовенно як замісник плазми крові для підтримання осмотичного тиску та об’єму циркулюючої крові;
Ø при втратах рідини організмом внаслідок блювоти, проносу, опіків;
– 5-10% розчин (гіпертонічний)– зовнішньо для промивання гнійних ран.
· NaBr, KBr – заспокійливі засоби.
· NaІ, КІ – при недостачі йоду в організмі (ендемічному зобі).
· KCl – при гіпокаліємії внаслідок прийому діуретиків;
– антиаритмічний засіб;
– для приготування сольових розчинів (плазмозамінників) при втратах
рідини.
· CaCl2 –при алергічних захворюваннях (знімає набряки, запалення);
– кровоспинний засіб;
–знімає спазми серцево–судинної системи;
– при переломах кісток;
– при недостачі кальцію в організмі.
· Хлорне вапно СаOCl2 (хлорид – гіпохлорит кальцію) використовують для
дезинфекції приміщень, туалетів, вигрібних ям.
· HCl –при зниженій кислотності шлунку.
· 5 – 10 % спиртовий розчин І2 –антисептичний засіб для обробки ран.
Дата добавления: 2015-08-26; просмотров: 1594;
