Оксиген
 | |||
| |||
| Фізичні властивості | |
| Кисень О2 Газ без кольору та запаху, малорозчинний у воді. | Озон О3 Газ блакитного кольору, з запахом свіжості, добре розчинний у воді. |
| Хімічні властивості | |
| Кисень О2 · з металами: 2Mg + O2 = 2MgO · з неметалами: С + О2 = СО2 · зі складними речовинами: 2ZnS + 3O2 = 2ZnO + 2SO2 | Озон О3 · легко розкладається: 2О3 = 3О2 · з благородними металами: 2Ag + O3 = Ag2O + O2 |
| Добування | |
| Кисень О2 У промисловості: · фракційна перегонка зрідженого повітря; · електроліз води: 2Н2О = 2Н2 + О2 У лабораторії: · 2KMnO4 = K2MnO4 + MnO2 + O2 · 2KClO3 = 2KCl + 3O2 · 2H2O2 = 2H2O + O2 | Озон О3
гроза
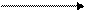 2O3 3O2 2O3 3O2
|
| Застосування у медицині | |
| Кисень О2 · штучне дихання; · кисневі коктейлі; · газовий наркоз(80% О2 та 20% N2O) | Озон О3 · прилад озонатор використовують для очищення повітря та води від мікроорганізмів. |
Вода
Фізичні властивості:
Прозора рідина, без кольору та запаху, кипить при t° = 100°С, замерзає при t° = 0°С. Густина води 1 г/см3.
Хімічні властивості:
· з металами:
до Al
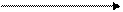
 MeOH + H2
MeOH + H2
Mn – Cr
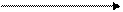
 Ме + Н2О MeO + H2
Ме + Н2О MeO + H2
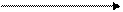 після Cr
після Cr
не взаємодіють
· з оксидами лужних та лужноземельних металів:
ВаО + Н2О = Ва(ОН)2
· з кислотними оксидами (крім SiO2):
CO2 + H2O = H2CO3
Використання у медицині:
Дистильована вода –це вода, очищена шляхом прямої перегонки.
Гідрогену пероксид
Фізичні властивості:
Сиропоподібна в’язка рідина (ρ = 1,44 г/см3), без кольору, з високою температурою кипіння 150°С. З водою змішується у будь–яких співвідношеннях. Попадання на шкіру викликає опіки.
Хімічні властивості
· Нестійкий: 2H2O2 = 2H2O + O2↑
· Слабкі кислотні властивості:
H2O2 + Ba(OH)2 = BaO2 + 2H2O
· Сильний окисник:
Ø в кислому середовищі H2O2 + 2H+ + 2ē = 2H2O
H2O2 + 2KI + H2SO4 = I2 + K2SO4 + 2H2O
Ø в лужному середовищі H2O2 + 2ē = 2OН–
3H2O2 + 2CrCl3 + 10NaOH = 2Na2CrO4 + 6NaCl + 8H2O
· Відновник: H2O2 – 2ē = O2 + 2H+
5H2O2 + 2KMnO4 + 3H2SO4 = 5O2↑ + 2MnSO4 + K2SO4 + 8H2O
Цю реакцію використовують у кількісному аналізі для визначення вмісту H2O2.
Добування:BaO2 + H2SO4 = H2O2 + BaSO4↓
Застосування у медицині:
3% розчин Н2О2 –дезинфікуючий засіб: 2H2O2 = 2H2O + O2↑
Чисельні бульбашки кисню, що виділяється, вбивають хвороботворні бактерії та виносять на поверхню рани забруднення.
Перевагою H2O2 порівняно з іншими окисниками є м’якість дії та нешкідливість продуктів відновлення.
Дата добавления: 2015-08-26; просмотров: 732;
