Рівні структурної організації білкових молекул
Первинна структура білків – це конфігурація поліпептидного ланцюга, яка формується в результаті утворення кислотоамідного (пептидного) зв’язку між залишками амінокислот. При синтезі пептиду α-карбоксильна група однієї амінокислоти взаємодіє з α-аміногрупою другої амінокислоти, утворюючи пептидний зв’язок із виділенням молекули води:

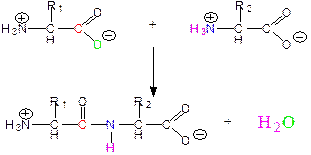 |
Пептидний зв’язок, що утворюється іміногрупою проліну, відрізняється від інших пептидних зв’язків – у атома азоту пептидної групи відсутній водень, замість нього є зв’язок із радикалом, як наслідок, один бік циклу включається в пептидний каркас:
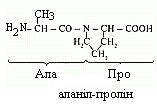 |
При взаємодії двох амінокислот утворюється дипептид, трьох – трипептид і так далі аж до утворення величезного поліпептиду. Умовно прийнято, що пептиди, які містять від 2 до 20 амінокислотних залишків, належать до олігопептидів; ті, що мають від 20 до 50 амінокислотних залишків, – до поліпептидів. Пептидні ланцюги, які об’єднують понад 50 амінокислот і мають молекулярну масу, більшу за 6000, належать до білків.
Амінокислотні залишки у пептидних ланцюгах різних білків чергуються не випадковим чином, а розташовані в певному порядку. Назви пептидів складаються з назв амінокислот, які входять до їх складу. Амінокислотний залишок, який має вільну α-аміногрупу, називається N-кінцевим, а той, що має вільну α-карбоксильну групу – С-кінцевим. Пептиди записують і читають із N-кінця до С-кінця. Наприклад, у тетрапептиді тир-ліз-глу-про N-кінцевою амінокислотою є тирозин, а С-кінцевою – пролін.
Оскільки до складу пептидів α-амінокислоти входять у формі ацилів, то в назві пептидів вони набувають характерного для ацилів закінчення -іл(-ил) замість ін(-ин), тобто «тирозил» замість «тирозин», «лізил» замість «лізин», «глутаміл» замість «глутамінової кислоти» і т.ін. Найменування пептидів складається з назви першої N-кінцевої амінокислоти із закінченням -іл(-ил), наступних амінокислот із таким самим закінченням і повної назви амінокислоти, яка має вільну α-карбоксильну групу (С-кінцева амінокислота). Отже, наведений вище тетрапептид має назву тирозил-лізил-глутаміл-пролін. У структурних формулах пептидів амінокислоту з кінцевою α-аміногрупою (N-кінцева амінокислота) пишуть ліворуч, а з кінцевою α-карбоксильною групою (С-кінцева амінокислота) – праворуч.
Первинна структура кожного індивідуального білка закодована в молекулі ДНК і реалізується в ході транскрипції (передача закодованої в ДНК інформації молекулам мРНК) та трансляції (синтезу білка).
Пептидні зв’язки дуже міцні, для їхнього хімічного неферментативного гідролізу використовують жорсткі умови: гідроліз білка проводять у концентрованій сірчаній кислоті при температурі близько 110 °С упродовж 24 годин. У живій клітині пептидні зв’язки можуть розриватися за допомогою протеолітичних ферментів, що мають назву протеази або пептидгідролази.
Із виявлених особливостей у будові пептидного зв’язку Л. Полінгом і Р. Корі були сформульовані три постулати (принципи формування пептидного зв’язку):
1) атоми, що утворюють пептидний зв’язок, є копланарними (розміщені в одній площині); обертання атомів або груп атомів навколо пептидного зв’язку неможливе;
2) принцип еквівалентності внеску амінокислотних залишків в утворення пептидного зв’язку і тим самим в утворення поліпептидного ланцюга (виняток – пролін);
3) принцип максимуму водневих зв’язків. У білках атоми водню та кисню практично завжди розміщуються у транс-конформації. Це зумовлює можливість утворення в поліпептидному ланцюгу максимуму водневих зв’язків.
Первинну структуру білка стабілізують (підтримують):
- пептидні зв’язки (між амінокислотними залишками);
- дисульфідні зв’язки (між вільними –SH-групами цистеїну).
Первинна структура білка несе інформацію про його просторову структуру.
Вторинна структура білків –локальна конформація, зумовлена обертанням окремих ділянок поліпептидного ланцюга навколо одинарних ковалентних зв’язків.
Основні зв’язки, які стабілізують вторинну структуру, – водневі зв’язки між атомами пептидних груп амінокислот у складі одного й того самого пептидного ланцюга або між різними пептидними ланцюгами.
Види вторинної структури:
· α-спіраль(правозакручена)
В α-спіралі водневі зв’язки утворюються між атомом кисню карбонільної групи і воднем амідного азоту 4-ї від нього амінокислоти. Водневі зв’язки розташовані паралельно осі спіралі і повторюються багато разів, тому міцно утримують спіралеподібну структуру у дещо напруженому стані (як стиснуту пружину). Бічні радикали амінокислотних залишків розміщуються по периферії спіралі й не беруть участі в утворенні вторинної структури. α-спіраль має певні характеристики: ширину, відстань між двома витками спіралі. Крок спіралі (один повний виток) 5,4Å (0,54 нм) становлять 3,6 амінокислотних залишків на виток, а на один амінокислотний залишок припадає 0,15 нм. Кут підіймання спіралі 26°, через 5 витків спіралі (18 амінокислотних залишків) структурна конфігурація поліпептидного ланцюга повторюється. Це означає, що період повторюваності (або ідентичності) α-спіральної структури становить 2,7 нм.
Білок не може мати в ланцюгу 100 % α-спіралей і зберігати глобулярність. Він у цьому випадку буде фібрилярним. Більш того, якщо є α-спіраль, вона знаходиться, як правило, в одній, двох або декількох окремих ділянках ланцюга.
Порушення спіральної структури може бути спричинене багатьма факторами. Наприклад, наявністю залишку проліну, циклічна структура якого вносить перегин у пептидний ланцюг; наявністю локального електростатичного відштовхування, зумовленого кластером позитивно заряджених R-груп лізину й аргініну, або кластером негативно заряджених R-груп глутамінової й аспарагінової кислот та іншими причинами. Неспіральна частина пептидного ланцюга може мати структуру складчастого листа або статистичного клубка.
· β-структураформується між лінійними ділянками пептидного каркасу одного поліпептидного ланцюга, утворюючи при цьому складчасті структури. Стабілізується β-структура водневими зв’язками між С=О та NH-групами. Поліпептидні ланцюги або їхні частини можуть формувати паралельні або антипаралельні β-структури. У паралельному складчастому листі обидва пептидні ланцюги або дві різні ділянки одного й того самого пептидного ланцюга мають у просторі однаковий напрям (збігаються N- і С-кінці пептидних ланцюгів). В антипаралельному складчастому листі ланцюги спрямовані у протилежні боки (N- і С-кінці пептидних ланцюгів мають протилежний напрям). У деяких білків β-структури можуть формуватися за рахунок утворення водневих зв’язків між атомами пептидного каркасу різних поліпептидних ланцюгів. У природних білках і пептидах трапляються обидві структури, але антипаралельна є більш стабільною,тому і більш поширеною.
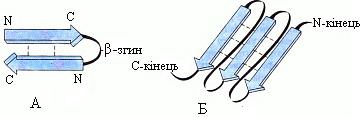 |
Рисунок . Паралельні (А) та антипаралельні (Б)
Дата добавления: 2015-08-26; просмотров: 4253;
