Природні пептиди: класифікація, біохімічна характеристика
В організмі людини виробляється безліч пептидів, що беруть участь у регуляції різних біологічних процесів і мають високу фізіологічну активність. Кількість амінокислотних залишків у структурі біологічно активних пептидів може варіювати від 3 до 50. До найменшого розміру пептидів можна віднести тиреотропін-рилізинг-гормон і глутатіон (трипептиди), а також енкефаліни, що мають у своєму складі 5 амінокислот. Однак більшість біологічно активних пептидів має у своєму складі більше 10 амінокислот, наприклад, нейропептид Y (регулятор апетиту) містить 36 амінокислот, а кортиколіберин – 41 амінокислоту.
Як правило, пептидні гормони синтезуються з неактивних білкових попередників, в яких специфічні протеолітичні ферменти руйнують певні пептидні зв’язки. Ангіотензин II – октапептид, що утворюється з великого білка плазми крові ангіотензиногену в результаті послідовної дії двох протеолітичних ферментів. Перший протеолітичний фермент ренін відщеплює з N-кінця ангіотензиногену пептид, що містить 10 амінокислот – ангіотензин I. Другий протеолітичний фермент карбоксидипептидилпептидаза відщеплює від С-кінця ангіотензину I дві амінокислоти, в результаті чого утворюється біологічно активний ангіотензин II, який бере участь у регуляції артеріального тиску і водно-сольового обміну в організмі.

Проте у деяких біологічно активних пептидах можуть міститися зв’язки між амінокислотами, що не трапляються в білках. Наприклад, у трипептиді глутатіоні, що побудований із глутамату, цистеїну і гліцину, N-кінцева амінокислота глутамат зв’язана із другою амінокислотою цистеїном не через свою α-карбоксильну групу, а через γ-карбоксильну групу свого бічного радикала.
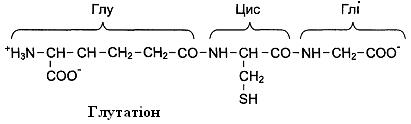
Глутатіон – значно поширений пептид організму людини. Він може бути використаний в окисно-відновних реакціях як донор і акцептор водню і необхідний для роботи низки ферментів.
Функції пептидів залежать від їх первинної структури. Ангіотензин I за структурою дуже схожий на ангіотензин II (має тільки дві додаткові амінокислоти з С-кінця), але при цьому не має біологічної активності. Зміна в амінокислотному складі пептидів часто призводить до втрати одних і появи інших біологічних властивостей. Як приклад можна розглянути структуру і властивості двох пептидних гормонів – окситоцину і вазопресину. У гіпоталамусі окситоцин і вазопресин утворюються в результаті часткового (обмеженого) протеолізу білкових попередників більшого розміру. Із гіпоталамуса по нервових волокнах ці гормони всередині секреторних гранул переміщаються в нервові закінчення аксонів, що знаходяться в задній частці гіпофіза. Після дії специфічних стимулів ці гормони виділяються в кров. Окситоцин і вазопресин у своїй структурі мають багато спільного: обидва містять по 9 амінокислотних залишків; 7 амінокислотних залишків із 9 ідентичні; 2 залишки цистеїну з’єднані дисульфідним зв’язком; на С-кінці пептидів α-карбоксильна група глутамату амідована. Незважаючи на невеликі відмінності в послідовності амінокислот (заміни амінокислот у положеннях 3 і 8), ці гормони сильно відрізняються за фізіологічною дією. Так, окситоцин виділяється в кров під час годування дитини, викликає скорочення міоепітеліальних клітин проток молочних залоз і стимулює виділення молока. Крім того, окситоцин впливає на гладку мускулатуру матки під час пологів, викликаючи її скорочення. На відміну від окситоцину, основна фізіологічна дія вазопресину – збільшення реабсорбції води в нирках при зменшенні артеріального тиску або об’єму крові (тому інша назва цього гормону – антидіуретичний). Крім того, вазопресин викликає вазоконстрикторну дію.
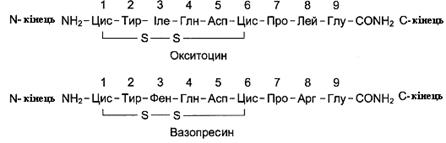 |
Оскільки пептиди – потужні регулятори біологічних процесів, їх можна використовувати як лікарські препарати. Основна перешкода для терапевтичного використання – їх швидке руйнування в організмі. Одним із найважливіших результатів досліджень є не тільки вивчення структури пептидів, але й одержання синтетичних аналогів природних пептидів із цілеспрямованими змінами в їх структурі та функціях. Наприклад, синтезований пептид 1-дезаміно-8-D-аргінін-вазопресин (ДАВ). У структурі цього пептиду (порівняно із вазопресином) немає аміногрупи на N-кінці, і замість L-аргініну в положенні 8 стоїть D-аргінін. Такий синтетичний пептид має тільки антидіуретичну активність і хімічно стійкий, тобто при введенні в організм викликає тривалу реакцію. Такий штучний аналог гормону (порівняно із природним) більш ефективний при лікуванні гормональної недостатності.
Відкриті та вивчені на даний час пептиди можна класифікувати на групи за їх основною фізіологічною дією:
· пептиди, що мають гормональну активність (окситоцин, вазопресин, рилізинг-гормони гіпоталамуса, меланоцитстимулювальний гормон, глюкагон та ін.);
· пептиди, що регулюють процеси травлення (гастрин, холецистокінін, вазоінтестинальний пептид та ін.);
· пептиди, що регулюють тонус судин і артеріальний тиск (брадикінін, калідин, ангіотензин ІІ);
· пептиди, що регулюють апетит (лептин, нейропептид Y, меланоцитстимулювальний гормон, β-ендорфіни);
· пептиди, що мають знеболювальний ефект (енкефаліни та ендорфіни та інші опіоїдні пептиди). Знеболювальний ефект цих пептидів у сотні разів перевищує аналгезуючий ефект морфіну;
· пептиди, що беруть участь у регуляції вищої нервової діяльності, в біохімічних процесах, пов’язаних із механізмами сну, навчання, пам’яті, виникнення почуття страху і т.д.;
· пептиди-антиоксиданти (глутатіон).
Однак такий розподіл пептидів дуже умовний. З’явилися дані про те, що багато пептидів мають широкий спектр дії. Так, меланоцитстимулювальний гормон, крім стимуляції пігментоутворення, бере участь у регуляції апетиту (разом із лептином пригнічує споживання їжі і є антагоністом нейропептиду Y). У той самий час β-ендорфіни, крім анальгезуючого ефекту, є синергістами нейропептиду Y, тобто посилюють апетит. Вазопресин, крім антидіуретичної та судинозвужувальної дії, має властивість покращувати пам’ять.
Дата добавления: 2015-08-26; просмотров: 4351;
