гель-фільтрації
Ультрацентрифугування.Цей метод базується на різній швидкості седиментації (осадження) білкових молекул у розчині хімічно інертної речовини (сахарози або хлориду цезію). Для покращання роздільної здатності ультрацентрифуги використовують розчин із різним градієнтом густини: концентрація розчину і, отже, його густина збільшуються в напрямку від поверхні до дна центрифугувальної пробірки. У міру переміщення молекул білка в центробіжному полі вони розділяються за молекулярною масою: фракції важчих білків при ультрацентрифугуванні розміщуються ближче до дна пробірки, легші білки – ближче до поверхні. При цьому утворюються межі білок-розчинник, які реєструють і розраховують швидкість їх переміщення. Спочатку вираховують константу седиментації білка (S), яка залежить від маси і форми білкової молекули,
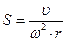 ,
,
де υ – швидкість переміщення межі білок-розчинник;
ω – кутова швидкість ротора, рад/с;
r – відстань від центра ротора до середини пробірки із розчином білка, см.
Величина молекулярної маси обчислюється за рівнянням Сведберга
M.M 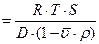 ,
,
де R – газова стала, ерг/(моль×град);
T – абсолютна температура (за шкалою Кельвіна);
S – константа седиментації;
ρ – густина розчинника;
ύ – парціальний питомий об’єм молекули білка;
D – коефіцієнт дифузії.
8.2.3. Розділення білків за зарядом. Іонообмінна хроматографія.Метод базується на зв’язуванні іонізованих груп білків із протилежно зарядженими групами іонообмінних смол (катіонообмінників чи аніонообмінників). Щільність зв’язування білка із смолою пропорційна заряду білка. Для розділення кислих і нейтральних білків використовують аніонообмінники для розділення основних білків – катіонообмінники. Білки, адсорбовані на іонообмінному полімері, можна змити буферним розчином із наростаючими концентраціями солі: чим менший заряд білка, тим менша концентрація солі потрібна, щоб змити білок, який зв’язаний з іоногенними групами смоли. Прикладами катіонообмінників є сильнокисла полістиренова смола (Dowex-50), слабокисла карбоксиметил (КМ) целюлоза, слабокисла полістиренова смола (Chelex-100). До аніонообмінників належить сильноосновна полістиренова смола (Dowex-1). Цей процес повністю автоматизовано: використовується спеціальний прилад – амінокислотний аналізатор.
Електрофорез на папері. Електрофорез – метод розділення заряджених частинок в електричному полі. Цей метод використовують в основному для фракціонування білків сироватки крові. Розділення сироваткових білків на фракції (альбумін, α1-глобуліни, α2-глобуліни, β-глобуліни, γ-глобуліни) стає можливим завдяки тому, що білки сироватки крові в лужному буферному розчині при дії постійного електричного струму мігрують із різною швидкістю внаслідок їх різного за силою негативного заряду. Так, альбумін, що має найбільший негативний заряд молекули, мігрує в електричному полі найшвидше порівняно з іншими білками до позитивно зарядженого анода. Після розділення білки зафарбовують і отримують електрофореграму. Вміст окремої білкової фракції визначають за кількістю зв’язаного з нею барвника (наприклад, бромфенолового синього). Для побудови графіків кількісного співвідношення фракцій за допомогою приладу для оцифрування результатів, який містить фотоелемент, вимірюють інтенсивність забарвлення окремих білкових фракцій (отримують денситограму електрофореграми).
Таблиця 2 – Вміст окремих білкових фракцій у сироватці крові здорової людини
| Назва фракції | Концентрація, г/л | Відносний вміст, % |
| Альбумін | 35–50 | 52–65 |
| α1-глобуліни | 2–4 | 4,2–7,2 |
| α2-глобуліни | 5–9 | 6,8–12 |
| β-глобуліни | 6–11 | 9,3–15 |
| γ-глобуліни | 11–15 | 15–19 |
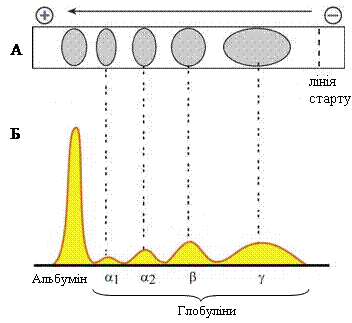 |
Рисунок 7 – Схема електрофореграми (А) та денситограма електрофореграми (Б) білків сироватки крові
8.2.4. Розділення білків за зарядом і молекулярною масою. Гель-електрофорез.Цей метод базується на різній швидкості міграції білків і пептидів в електричному полі залежно не лише від знака заряду, а й від молекулярної маси. Носіями для гель-електрофорезу можуть служити поліакриламідний гель, крохмальний гель, агароза та ін. Молекули, що розділяються, рухаються в гелі залежно від їх розміру: ті з них, які мають великі розміри, будуть затримуватися при проходженні через пори гелю. Менші молекули зустрічатимуть менший опір і відповідно рухатимуться швидше. У результаті після проведення електрофорезу великі молекули знаходитимуться ближче до старту порівняно з меншими.
 |
Рисунок 8 – Схема розділення білків методом
гель-електрофорезу:
А – нанесення зразків у гель;
Б – камера для електрофорезу;
В – електрофореграма білків
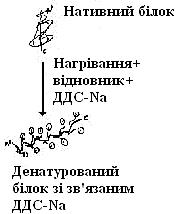
Методом електрофорезу можна розділити білки за молекулярною масою. Для цього використовують електрофорез у поліакриламідному гелі (ПААГ) за наявності додецилсульфату натрію (ДДС-Na). ДДС-Na є дифільною речовиною та містить заряджену й гідрофобну групи. Білки зв’язуються з ДДС-Na своїми гідрофобними радикалами й при цьому денатурують. Таким чином, білки вирівнюються за формою та зарядом. Після цього рухливість білка при електрофорезі залежить тільки від його молекулярної маси.
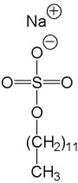 Додецилсульфат натрію (ДДС-Na)
Додецилсульфат натрію (ДДС-Na)
| 
|
У випадку використання імунологічних методів для виявлення розділених білків говорять про імуноелектрофорез. На першому етапі проводять електрофоретичне розділення білків у поліакриламідному гелі, після чого білки переносять із гелю на мікропористу нітроцелюлозну мембрану та детектують заданий білок із використанням специфічних до нього антитіл.
Ізоелектричне фокусування.Це один із найефективніших і найпоширеніших методів фракціонування та очищення білків. Цей метод дозволяє розділити білки, що відрізняються за ізоелектричною точкою тільки на 0,01. Суміш білків, які піддають розділенню, вносять у колонку або наносять на пластину, заповнену електропровідною рідиною. Розділення білків відбувається залежно від їх заряду в градієнті pH, що створюється за допомогою синтетичних сумішей поліамінополікарбонових кислот (амфолітів) під дією електричного поля. Проводять спочатку електрофорез у горизонтальному напрямі. Білки розділяються залежно від величини заряду (рух білка припиняється, коли значення рН дорівнює ізоелектричній точці для даного білка). Потім обробляють пластину розчином ДДС-Na і проводять електрофорез у вертикальному напрямі. Тепер білки розділяються залежно від молекулярної маси. Виявлення білків після їх розділення ізоелектричним фокусуванням проводять тими самими методами, що використовують після звичайного гель-електрофорезу, – забарвленням спеціальними барвниками з урахуванням того, що амфоліти здатні утворювати з ними комплекси.
8.2.5. Розділення білків за здатністю до специфічних взаємодій. Афінна хроматографія. Метод базується на здатності білків міцно зв’язуватися з різними молекулами, але нековалентними зв’язками. Використовується для виділення й очищення ферментів, імуноглобулінів, рецепторних білків.
Молекули речовин (ліганди), з якими специфічно зв’язуються певні білки, ковалентно сполучають з інертним полімером (рисунок 9 (А)). При пропусканні розчину білків через колонку з полімером на колонці адсорбується лише специфічний для даного ліганду білок за рахунок комплементарного зв’язування білка з лігандом. Решта білків вільно виходять із колонки разом із розчинником (рисунок 9 (Б)). Затриманий білок потім можна вимити з колонки за допомогою буферного розчину, що містить у високій концентрації вільний ліганд (рисунок 9 (В, Г)). Часто використовують вільний ліганд, що має вищу спорідненість до білка, ніж у фіксованого на полімері ліганду.
Цей високочутливий метод дозволяє виділити в чистому вигляді дуже малі кількості білка з клітинного екстракту, що містить сотні інших білків. Одним із варіантів цього методу є імуноафінна хроматографія: до частинок полімеру приєднуть антитіла до певного білка, що забезпечує з дуже високою специфічністю затримку на колонці цього білка.
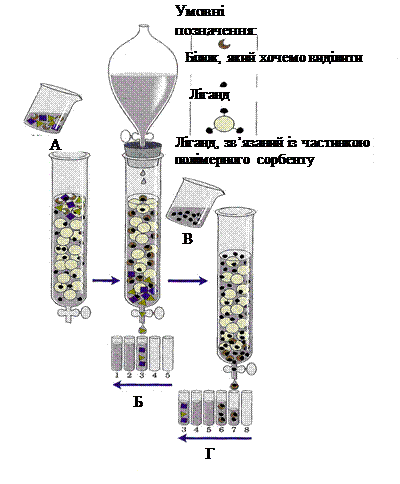
Рисунок – Схема розділення білків методом афінної хроматографії
9. Коротка історична довідка
1820 р. – виділено першу амінокислоту – гліцин – із кислотного гідролізату желатину (А. Браконно);
1838 р. – уперше проведено систематичні дослідження білків (Г. Мульдер);
1838 р. – запропоновано термін “протеїн” (Я. Берцеліус);
1871 р. – встановлено факт розщеплення білка (казеїну) до амінокислот травними соками (М. Любавін);
1902 р. – відкриття пептидного зв’язку (Е. Фішер);
1910 р. – висунуто ідею про те, що білки побудовані в основному з амінокислот (А. Коссель);
20-ті роки XX ст. – визначення молекулярної маси білків методом ультрацентрифугування (Т. Сведберг);
1935 р. – відкрито треонін – останню з числа незамінних амінокислот (А. Розе);
1948 р. – за розроблення методу електрофорезу у вільній фазі А. Тизеліус нагороджений Нобелівською премією;
1951 р. – сформульовано теорію формування вторинної структури білка – теорію спіралей (Л. Полінг і Р. Корі). Нобелівська премія 1952 р.;
1952 р. – за розроблення методу розподільної хроматографії на папері А. Мартін і Р. Сінг нагороджені Нобелівською премією;
1955 р. – встановлено первинну структуру інсуліну (Ф. Сенджер). Нобелівська премія 1952 р.;
1962 р. – встановлено просторову структуру білків за допомогою рентгеноструктурного аналізу (М. Перутц, Дж. Кендрю).
Питання для самоконтролю
1.Охактеризйте біологічні функції білків і пептидів
2.Як класифікують амінокислоти?
3.Яка загальна формула амінокислот?
4.Яка функціональна роль протеїногенних амінокислот?
5.У чому особливості різних рівнів структурної організації білкових молекул?
6.Коротко охарактеризуйте основні природні пептиди?
7.За якими ознаками класифікують білки?
8.Які фізико-хімічні властивості білків?
9.Перелічіть основні методи дослідження білків?
Дата добавления: 2015-08-26; просмотров: 3520;
