Раздел 2. ТЕРМОДИНАМИКА БИОЛОГИЧЕСКИХ ПРОЦЕССОВ
О.Г. Лунева, А.А. Черкашин, А.О. Шумарина, П.А. Мамонов
Основные понятия и законы термодинамики
Предметом термодинамики является изучение закономерностей тепловой формы движения материи и связанных с ней физических явлений. Термодинамика изучает закономерности теплового движения в равновесных системах и при переходе систем в равновесие (равновесная термодинамика), а также обобщает эти закономерности на неравновесные системы (неравновесная термодинамика, или термодинамика необратимых процессов). Термодинамической системой может являться любой макроскопический материальный объект. Выделение термодинамической системы состоит в указании границы, отделяющей ее от остального, внешнего по отношению к данной системе, мира.
В зависимости от характера обмена энергии и массы с окружающей средой через границы системы различают три группы систем:
- изолированные – не обмениваются с внешней средой ни энергией, ни массой,
- закрытые – обмениваются с внешней средой энергией, но не могут обмениваться массой,
- открытые – обмениваются с внешней средой массой и энергией.
Процессы, протекающие в системе, бывают:
- обратимыми (равновесными) – протекают в системе таким образом, что вызванные ими изменения в состоянии системы могут произойти в обратной последовательности без дополнительных изменений в окружающей среде,
- необратимыми (неравновесными) – протекание этих процессов в обратном направлении сопровождается остаточными изменениями в окружающей среде.
В равновесном состоянии системы свойства системы не изменяются во времени и в ней отсутствуют направленные потоки вещества и энергии.
В неравновесном состоянии системы малые воздействия могут вызвать изменение состояния системы.
В стационарном состоянии системы свойства системы не изменяются во времени, но присутствуют направленные потоки вещества и энергии, взаимно уравновешивающие друг друга.
Пусть в системе протекают последовательные химические реакции

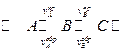 ,
,
Тогда скорость изменения концентрации вещества В
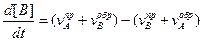 ,
,
где 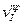 и
и 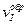 - скорости прямой и обратной реакций, соответственно.
- скорости прямой и обратной реакций, соответственно.
В равновесном состоянии
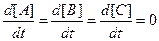 ;
;
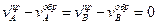 .
.
В стационарном состоянии
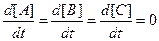
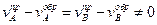 .
.
В неравновесном состоянии
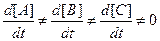 .
.
Первый закон термодинамики – это закон сохранения энергии в применении к процессам преобразования теплоты. Его математическая формулировка:
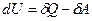 , (2.1)
, (2.1)
где 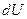 - изменение внутренней энергии системы,
- изменение внутренней энергии системы, 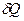 - количество переданной системе теплоты,
- количество переданной системе теплоты, 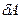 - работа.
- работа.
В системе, где протекает химическая реакция, 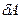 включает работу против сил внешнего давления
включает работу против сил внешнего давления 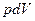 и максимально полезную работу
и максимально полезную работу 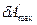 , сопровождающую химические реакции
, сопровождающую химические реакции
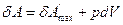 . (2.2)
. (2.2)
Знаки теплоты и работы выбирают следующим образом: теплота считается положительной, если она передается системе; работа считается положительной, если она совершается системой над окружающей средой.
При постоянном давлении вводится еще одна функция состояния системы – энтальпия Н
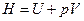 ,
, 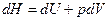 . (2.3)
. (2.3)
Как правило, химические реакции протекают при постоянных давлении и объеме. В этих условиях теплота является функцией состояния.
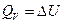 при постоянном объеме,
при постоянном объеме,
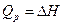 при постоянном давлении.
при постоянном давлении.
Величины 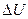 и
и 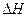 зависят только от начального и конечного состояния системы и не зависят от пути, по которому может происходить превращение. Большинство биохимических процессов протекает при постоянном давлении, а объем системы почти не меняется, тогда
зависят только от начального и конечного состояния системы и не зависят от пути, по которому может происходить превращение. Большинство биохимических процессов протекает при постоянном давлении, а объем системы почти не меняется, тогда 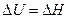 .
.
Зная теплоты образования продуктов реакции и реагентов, можно вычислить выделившуюся или поглощенную теплоту химической реакции, так как тепловой эффект реакции, протекающей при постоянном давлении и объеме, не зависит от пути реакции, а определяется только разницей энтальпий исходных веществ и продуктов реакции (закон Гесса):
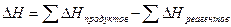 . (2.4)
. (2.4)
Это соотношение позволяет вычислить 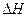 для любой химической реакции, в том числе для реакций, которые невозможно изучать экспериментально.
для любой химической реакции, в том числе для реакций, которые невозможно изучать экспериментально.
Изменение энтальпии при образовании 1 моль химического соединения из простых веществ, находящихся в наиболее устойчивом стандартном состоянии (1 атм, 25˚С) называется стандартной теплотой образования данного вещества (ΔН°). Энтальпия образования устойчивых простых веществ в стандартном состоянии принимается равной нулю при любой температуре.
Если ΔН° - отрицательная величина, то тепло выделяется в результате реакции. Теплота образования характеризует прочность химических связей, образовавшихся в результате реакции, то есть - ΔН° выражает количество тепла, которое надо «ввести» в соединение, чтобы разорвать его связи и образовать индивидуальные элементы. Для определения энтальпии образования конкретной химической связи надо обратиться к более простой молекуле. Например, биоорганические молекулы имеют связь С−Н и для того, чтобы определить ΔН° этой связи, можно рассмотреть образование молекулы метана СН4 из простых веществ.
При нагревании системы температура увеличивается пропорционально количеству поглощенного тепла, коэффициентом пропорциональности является теплоемкость
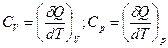 , (2.5)
, (2.5)
где символы V и р обозначают процесс, проходящий при постоянном объеме и давлении.
Средняя теплоемкость для одного моля вещества определяется выражением
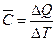 . (2.6)
. (2.6)
Для идеального газа теплоемкость можно выразить и через изменение внутренней энергии. При постоянном объеме механическая работа не совершается и теплота равна изменению внутренней энергии, поэтому
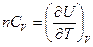 , (2.7)
, (2.7)
где n –количество молей идеального газа. При постоянном давлении
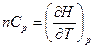 . (2.8)
. (2.8)
Второй закон термодинамики позволяет определять возможность и направление протекания термодинамических процессов. Он утверждает, что протекающий в изолированной системе самопроизвольный неравновесный процесс всегда вызывает увеличение энтропии до ее максимальных значений при окончании процесса и установлении термодинамического равновесия.
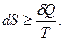 (2.9)
(2.9)
Для системы, не совершающей теплообмена с внешней средой, 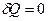 и уравнение принимает вид
и уравнение принимает вид
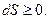 (2.10)
(2.10)
Следовательно, в изолированной системе энтропия остается неизменной в равновесных и возрастает в неравновесных процессах.
В отличие от первого закона термодинамики, имеющего абсолютное значение, второй закон носит статистический характер, т.е. увеличение энтропии в необратимых процессах отражает лишь наиболее вероятное их направление. Этот закон соблюдается наиболее точно для макроскопических систем с большим количеством молекул, где вероятности отклонения от среднестатистического их распределения в объеме системы крайне малы. В системах с малым количеством частиц вероятность таких отклонений увеличивается. Число возможных микросостояний, или способов распределения частиц, которыми осуществляется данное макросостояние системы, называется термодинамической вероятностью. Больцман установил связь между энтропией системы S и термодинамической вероятностью ее состояний W
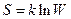 . (2.11)
. (2.11)
Термодинамические потенциалы (характеристические функции) – это термодинамические функции, которые выражают в явном виде все термодинамические свойства системы. Термодинамическими являются функции U – внутренняя энергия, H – энтальпия, F= U-TS - свободная энергия Гельмгольца (изохорно-изотермический потенциал), G=H-TS – свободная энергия Гиббса (изобарно-изотермический потенциал). Потенциальная функция, будучи продифференцирована по перемещению, дает силу, стремящуюся перевести или возвратить систему в равновесие.
На основании первого и второго законов термодинамики для равновесных (обратимых) процессов термодинамические потенциалы связаны следующими уравнениями:
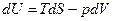 , (2.12)
, (2.12)
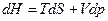 , (2.13)
, (2.13)
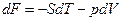 , (2.14)
, (2.14)
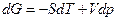 . (2.15)
. (2.15)
Эти уравнения справедливы для закрытых систем, где совершается только механическая работа. В термодинамических расчетах удобно применять последние два потенциала, так как их естественные переменные удобны для систем, где протекают химические реакции.
Изменение любого вида энергии, сопровождающее изменение количества вещества в системе называется химическим потенциалом µ, то есть
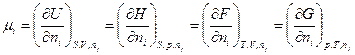 , (2.16)
, (2.16)
где ni – число молей i-го компонента системы, nj – постоянные количества всех компонентов кроме i-го.
Так как химические реакции, как правило, протекают при постоянных температуре и давлении, целесообразно использовать свободную энергию Гиббса, так как в этих условиях она обладает свойствами потенциала. Если происходят химические реакции или система является открытой, тогда
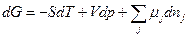 , (2.17)
, (2.17)
где µ - химический потенциал, 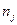 - количества веществ.
- количества веществ.
Если в системе имеет место изменение заряда системы, вместо химического потенциала используется электрохимический потенциал:
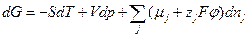 , (2.18)
, (2.18)
где 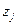 - заряд, F – число Фарадея, φ – электрический потенциал.
- заряд, F – число Фарадея, φ – электрический потенциал.
Уменьшение энергии Гиббса в случае обратимого процесса при постоянстве температуры и давления равно максимально полезной работе, которую может совершить система:
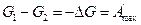 . (2.19)
. (2.19)
При неравновесных процессах 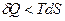 и работа будет меньше, чем максимальная работа равновесного процесса, тогда в общем виде для равновесных и неравновесных процессов:
и работа будет меньше, чем максимальная работа равновесного процесса, тогда в общем виде для равновесных и неравновесных процессов:
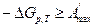 . (2.20)
. (2.20)
Пример 2.1. Вычислить стандартную теплоту образования угарного газа, если известно, что для реакции
С+О2→СО2 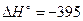 кДж/моль СО2,
кДж/моль СО2,
а для реакции
2СО+О2→2СО2 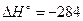 кДж/моль СО2.
кДж/моль СО2.
Решение: Данные химические реакции можно представить, как показано на рис. 2.1.
Рис. 2.1.
Тогда для химической реакции 2С+О2→2СО
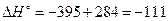 кДж/моль СО.
кДж/моль СО.
Химическую реакцию образования угарного газа из простых веществ невозможно провести экспериментально, так как часть углерода сгорает с образованием углекислого газа, поэтому энтальпию этой реакции можно только вычислить.
Пример 2.2. Вывести формулу для изменения энтропии ΔS одного моля идеального газа при изобарном нагревании (T0 – начальная температура, Т – конечная температура).
Решение: Согласно выражению (2.12)
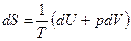 .
.
Из уравнения (2.7) и 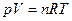 (уравнение состояния идеального газа):
(уравнение состояния идеального газа):
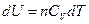 ,
, 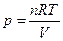 , тогда
, тогда
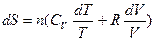 .
.
После интегрирования 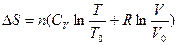 .
.
При р=const 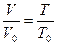 , тогда
, тогда 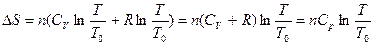 .
.
Для 1 моль идеального газа 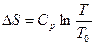 .
.
Пример 2.3. Получить выражение для химического потенциала одного моля идеального газа при постоянном давлении и температуре.
Решение: Химический потенциал при постоянном давлении это молярная энергия Гиббса (2.16).
Для 1 моль идеального газа 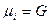 .
.
Из выражения (2.15) при постоянной температуре получаем
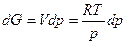
Интегрируем от G0 до G и от р0 до р:
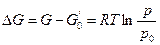
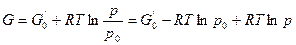
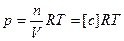 , тогда
, тогда
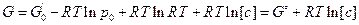
Т.к. для 1 моль идеального газа 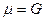 , то
, то
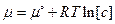 .
.
Пример 2.4. Температура плавления α-спирали составляет 50˚С. Энтальпия перехода спираль-клубок — 113 кДж·моль-1. Определить: а) энтропию перехода спираль-клубок; б) длину спирали, принимая, что выход каждого остатка из спирали добавляет системе по 3 степени свободы, и соответствующие координаты имеют по два устойчивых положения (система устойчива при двух значениях соответствующих координат); в) энтальпию разрыва водородной связи спирали.
Решение: а) Плавление спирали соответствует ситуации когда свободная энергия перехода спираль — клубок становится равной нулю:
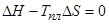 .
.
Отсюда,
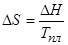
Энтропия перехода равна 350 Дж·моль-1·К-1.
б) Определим энтропию выхода остатка из спирали. Для этого воспользуемся формулой (2.11). Учитывая, что в результате выхода остатка из цепи у него появляется 3 дополнительные степени свободы, и соответствующие координаты имеют по два устойчивых положения, число микросостояний системы возрастает в 23 раз, тогда
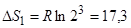 ( Дж·моль-1·К-1)
( Дж·моль-1·К-1)
Учитывая, что энтропия величина аддитивная, энтропия плавления спирали равна
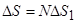 .
.
Отсюда число остатков в цепи N = 20.
в) Учитывая, что на остаток в α-спирали приходится по 2 водородные связи (образуемые его N-H и C=O группами), энтальпия разрыва водородной связи равна 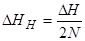 , что составляет 2,8 кДж·моль-1.
, что составляет 2,8 кДж·моль-1.
Дата добавления: 2015-06-22; просмотров: 2458;
