Химическое равновесие
Состояние равновесия характеризуется минимальными значениями термодинамических потенциалов.
Если на систему не действуют внешние силы, то есть полезная работа не совершается, тогда
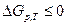 . (2.21)
. (2.21)
Таким образом, если известно изменение свободной энергии Гиббса при постоянной температуре и давлении, то можно предсказать направление самопроизвольного протекания термодинамического процесса, в частности химической реакции: самопроизвольно может протекать процесс, сопровождающийся уменьшением энергии Гиббса (при р=const и Т=const). Минимальное значение энергии Гиббса достигается при равновесии.
На основании выражения для химического потенциала можно вычислить значение свободной энергии Гиббса. Для химической реакции
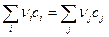 ,
,
где индексы i и j указывают исходные вещества и продукты реакции, используя выражение для химического потенциала (см. пример 1.3)
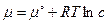 , получим
, получим
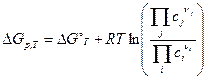 , (2.22)
, (2.22)
где 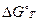 - стандартное значение свободной энергии Гиббса. Полученное уравнение называется уравнением изотермы химической реакции, или изотермой Вант-Гоффа.
- стандартное значение свободной энергии Гиббса. Полученное уравнение называется уравнением изотермы химической реакции, или изотермой Вант-Гоффа.
Значение 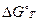 определяется константой равновесия химической реакции (Кр)
определяется константой равновесия химической реакции (Кр)
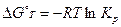 . (2.23)
. (2.23)
Зависимость константы равновесия от температуры описывается уравнением изобары Вант-Гоффа
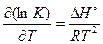
 . (2.24)
. (2.24)
Если принять, что ΔН реакции не зависит от температуры (что справедливо в узких интервалах температур), то
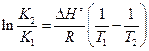 , (2.25)
, (2.25)
где К1 и К2 – константы равновесия химической реакции при температурах Т1 и Т2.
Значения 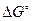 можно вычислить, исходя из энергии Гиббса образования исходных веществ и продуктов реакции, а также стандартных значений энтальпии и энтропии химической реакции:
можно вычислить, исходя из энергии Гиббса образования исходных веществ и продуктов реакции, а также стандартных значений энтальпии и энтропии химической реакции:
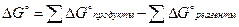 , (2.26)
, (2.26)
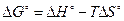 . (2.27)
. (2.27)
В справочниках обычно приводят стандартные значения энтальпии, энтропии и свободной энергии Гиббса при T =298 К и единичной активности компонентов. Однако в биологических системах активность ионов водорода нельзя принять равной единице (т.е. рН раствора около нуля). В биохимии выбирают стандартное состояние с единичной активностью всех компонентов, а активность ионов водорода принимают равной 10-7.
Используя уравнение (2.22) можно рассчитать значение свободой энергии Гиббса в стандартном состоянии, принятом в биохимических системах.
Множество химических реакций клеточного метаболизма не являются самопроизвольными. Энергия, необходимая для осуществления таких реакций , обеспечивается путем сопряжения с самопроизвольной реакцией. Таким образом, изменение свободной энергии в сопряженных реакциях становится отрицательным и суммарный (сопряженный) процесс является самопроизвольным. Наиболее распространенной «движущей» реакцией является гидролиз АТР.
Пример 2.5. Определите рК ионизации глицина при 298 К, если ∆Н° = 4,8 кДж/моль, ∆S° = -28,9 Дж/(моль·К).
Решение: 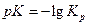 . Используя (2.23),
. Используя (2.23),
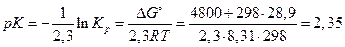 .
.
Пример 2.6. При изучении денатурации белка получена следующие значения констант равновесия:
| T, К | Кр |
| 0,316 | |
| 2,512 |
Рассчитайте 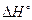 денатурации белка, а также константу равновесия,
денатурации белка, а также константу равновесия, 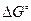 и
и 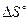 процесса при 37°С. Считать, что в рассматриваемом диапазоне температур
процесса при 37°С. Считать, что в рассматриваемом диапазоне температур 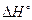 реакции не изменяется.
реакции не изменяется.
Решение: Используя выражение (2.25) рассчитаем 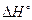
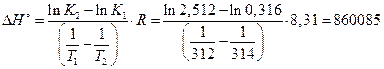 (Дж/моль)
(Дж/моль)
Значение константы равновесия при 37°С находим, используя вычисленное значение 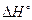 и значение константы равновесия при 39°С:
и значение константы равновесия при 39°С:
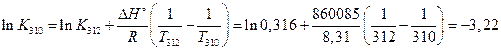
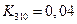
Согласно выражению (2.23) и (2.27)
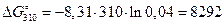 (Дж/моль),
(Дж/моль),
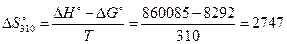 (Дж/(моль·К)).
(Дж/(моль·К)).
Пример 2.7. В живой клетке непрерывно ведется синтез АТФ из АДФ по уравнению
АДФ + Рi + Н+= АТФ + Н2О
Изменение свободной энергии при превращении 1 моль АДФ в АТФ, когда все реагенты и продукты находятся в стандартных состояниях (активности всех компонентов реакции равны 1), составляет -9,2 кДж/моль. Определить изменений свободной энергии в водном растворе с рН=7,0.
Решение:
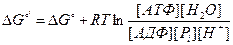 .
.
При рН=7,0 концентрация ионов водорода равна 10-7 М, концентрации реагентов и продуктов реакции принимаем равной 1, тогда
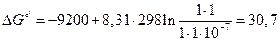 (кДж/моль)
(кДж/моль)
Полученный расчет показывает, что при снижении концентрации ионов водорода до 10-7 М, реакция протекает самопроизвольно в сторону гидролиза АТФ.
Дата добавления: 2015-06-22; просмотров: 1356;
