Валентно-химическое описание строения стекол
Основное внимание в данном подходе к проблеме строения стекол уделяется вопросам электронного строения атомов, участвующих в образовании стекла, и природы химической связи между его компонентами. Химическая связь между атомами возникает как результат электростатического (кулоновского) взаимодействия электронов и ядер атомов, участвующих в образовании соединения.
В настоящее время наука располагает несколькими теориями химической связи. Наиболее простой и, вероятно, в силу этого наиболее распространенной является классическая электронная теория, возникшая как результат обобщения моделей химической связи Льюиса и Косселя. Квантовомеханические теории – теория валентных связей, теория кристаллического поля и зонная теория твердых тел – все чаще привлекаются учеными для объяснения строения и свойств стекла.
Положения классической электронной теории получили широкое распространение в структурной химии стекла, что обусловлено, вероятно, такими ее достоинствами, как наглядность и завершенность физических моделей. Классическая электронная теория допускает возможность существования в соединении многозарядных ионов шаровой симметрии, как, например, ионов четырехзарядного кремния, анионов двухзарядноного кислорода и т. п. В свете современных представлений эти допущения не являются корректными. Однако, несмотря на условный характер основных понятий теории, таких, как многозарядные ионы, ионный радиус, поляризуемость, электроотрицательность, координационные группировки, они позволяют понять особенности химического строения стекол и предсказывать направление изменения их свойств в зависимости от состава.
Согласно классической электронной теории химическая связь в кварцевом стекле является преимущественно ковалентной. В бинарных щелочно-силикатных стеклах типа Ме2О–SiО2 можно выделить два вида ионно-ковалентных связей: ковалентные в цепочках атомов –Si–О–Si–О– и более ионные связи между щелочными катионами и анионным каркасом (степень ионности связи Na–О равна 82 %).
В рамках классической электронной теории стеклообразующие компоненты в оксидных системах должны иметь высокие заряды ионов, высокую прочность единичной связи, малые ионные радиусы и координационные числа и, как следствие, высокую напряженность поля и силу поля катиона (по Дитцелю). Компоненты-модификаторы, наоборот, имеют низкие заряды ионов, большие ионные радиусы и координационные числа в сочетании с низкой напряженностью поля.
Степень ионности-ковалентности связей Si–О, Me–О не является константой для всех видов стекол. Она зависит от состава стекла в целом. Это положение особенно четко проявляется при изучении спектров поглощения и люминесценции окрашенных стекол. Степень ионности связи «красящий ион – кислород» (А–О) зависит как от степени ионности связи «стеклообразователь – кислород» в цепочке А–О–R, где R – Si, В, Р и др., так и от степени ионности связи «модификатор – кислород». Установлены следующие закономерности:
- Чем выше ковалентность связи «стеклообразователь-кислород», тем более ионной является связь «красящий ион – кислород».
- Для серии стекол с одним и тем же стеклообразователем и разными модификаторами степень ионности связи «красящий ион – кислород» повышается по мере снижения степени ионности связи «модификатор – кислород». Например, при замене лития на натрий и калий в цепочке А–О–Si–О–Me, т. е. по мере повышения степени ионности связи Me–О от 76 % до 86 %, степень ионности связи А–О будет понижаться.
Зонная теория рассматривает строение внешних энергетических зон соединения: валентной зоны, запрещенной зоны и зоны проводимости. Особенности строения внешних зон и характер их заполнения электронами (см. рис. 1.9) позволяют не только классифицировать вещества на группы изоляторов, полупроводников и проводников, но и уверенно предсказать оптические, электрические, теплофизические и магнитные свойства веществ.
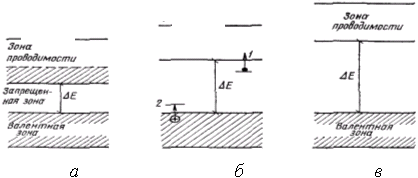
Рис. 1.9. Положение верхних энергетических зон в твердых телах:
а – проводники; б – полупроводники с примесной проводимостью;
в – диэлектрики; 1 – электронная проводимость; 2 – дырочная проводимость
Оксидные стекла на основе боратов, силикатов, фосфатов и т. д. принадлежат к классу диэлектриков, отличаются высокими значениями энергетического барьера (шириной запрещенной зоны ΔЕ) между валентной зоной и зоной проводимости, свободной от электронов. Тепловая энергия, а также энергия излучений оказываются недостаточными для возбуждения перехода электронов в зону проводимости. Этим объясняется высокая прозрачность, высокие электроизоляционные свойства, низкая теплопроводность оксидных стекол.
Дата добавления: 2015-06-17; просмотров: 1796;
