Фазовые переходы. Уравнение Клапейрона-Клаузиуса.
В системе, состоящей из нескольких фаз чистого вещества, находящихся в равновесии, возможны переходы вещества из одной фазы в другую. Такие переходы называются фазовыми переходами или превращениями агрегатных состояний.
Рассмотрим равновесный переход одного моля вещества из одной фазы (1) в другую (2), совершающийся при постоянных давлении и температуре. Энергии Гиббса (G1и G2) моля вещества в фазах 1 и 2 равны (условие равновесия). Следовательно:
G2 = G1 (IV, 1)
Напишем уравнения (III, 13б) полных дифференциалов для энергии Гиббса одного моля чистого вещества в двух равновесных фазах 1 и 2:
dG1 = V1dP – S1dT
dG2 = V2dP – S2dT (IV, 2)
Вычитая верхнее уравнение из нижнего, получим:
dG2 – dG1 = (V2 – V1) dP – (S2 – S1) dT
Изменения P и Т здесь были не независимыми, а такими, при которых сохранялось равновесие между фазами 1 и 2. Таким образом, между P и Т сохранялась функциональная связь, соответствующая фазовому равновесию. Поэтому, если G1 = G2 (равновесие при давлении P и температуре Т), то G1 + dG1 = G2 + dG2(равновесие при давлении P + dP и температуре T + dT), значит, dGl = dG2 или dG2 – dG1 = 0. Следовательно
(V2 – V1)dP – (S2 – S1)dT = 0
или
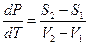 (IV, 3)
(IV, 3)
Взаимное превращение фаз рассматривалось как равновесное и изотермическое, поэтому:
S2 – S1 = DS = 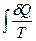 =
= 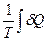 =
= 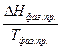 (IV, 4)
(IV, 4)
Здесь 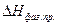 – теплота фазового превращения, поглощаемая при переходе моля вещества из фазы 1 в фазу 2; V2 – V1 – разность мольных объёмов двух фаз.
– теплота фазового превращения, поглощаемая при переходе моля вещества из фазы 1 в фазу 2; V2 – V1 – разность мольных объёмов двух фаз.
Из уравнений (IV, 3) и (IV, 4) получим:
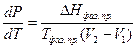 (IV, 5)
(IV, 5)
Уравнение (IV, 5) называется уравнением Клапейрона-Клаузиусаи является общим термодинамическим уравнением, приложимым ко всем фазовым переходам чистых веществ, т.е. к превращениям агрегатных состояний.
При превращении одной фазы в другую такие свойства как удельный или мольный объём, внутренняя энергия и энтропия одного грамма или одного моля вещества изменяются скачкообразно. Однако отсюда не следует, что внутренняя энергия всей двухфазной системы не является в этом случае непрерывной функцией её состояния. В самом деле, система, состоявшая в начале процесса, например, из некоторого количества льда при 0°С и 1 атм, при постоянном давлении и подведении теплоты превращается в двухфазную систему лед-жидкая вода, в которой по мере поглощения теплоты масса льда постепенно и непрерывно убывает, а масса воды растет. Поэтому также постепенно и непрерывно изменяются такие свойства системы в целом как внутренняя энергия, энтальпия, энтропия и др.
Дата добавления: 2015-05-21; просмотров: 751;
