Фазовые переходы первого рода. Плавление. Испарение.
Фазовые переходы, характеризующиеся равенством изобарных потенциалов двух сосуществующих в равновесии фаз и скачкообразным изменением первых производных по энергии Гиббса (энтропии и объема) при переходе вещества из одной фазы в другую, называются фазовыми переходами первого рода. К нимотносятся агрегатные превращения – плавление, испарение, возгонка и др.
При фазовых переходах первого рода скачкообразно могут изменяться и вторые производные от энергии Гиббса.
В системах с фазовыми переходами первого рода энергия Гиббса каждой из фаз
(G1 и G2) выражается различными функциями термодинамических параметров. Зависимости G1 и G2 от температуры в таких системах показаны на рис. Кривые G1 = f(T) и G2 = f(T) пересекаются при температуре фазового перехода 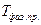 , при которой G1 = G2. и dG = 0. При Т <
, при которой G1 = G2. и dG = 0. При Т < 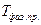 устойчивой является фаза 1, т.к. G1 < G2, а при Т >
устойчивой является фаза 1, т.к. G1 < G2, а при Т > 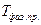 более устойчивой является фаза 2, т.к. G1 > G2.
более устойчивой является фаза 2, т.к. G1 > G2.
При фазовых переходах первого рода функции G1 = f(T) и G2 = f(T) в точке фазового перехода не имеют математических особенностей, и кривые этих функций продолжаются в обе стороны от этой точки (пунктирные кривые на рис. ).
Это значит, что в системах с фазовыми переходами первого рода имеется возможность существования метастабильных состояний (т.е., состояний неустойчивого равновесия физической системы, в которых система может находиться длительное время), например, переохлажденного (пересыщенного) пара или перегретой жидкости. Такие состояния иногда наблюдаются при медленном переходе через температуру 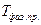 .
.
Из фазовых переходов первого рода рассмотрим подробнее плавление и испарение, представляющие более общий интерес, чем другие процессы.
Плавление.Теплота плавления – перехода твердой фазы в жидкую – всегда положительна. Объём (мольный, удельный) жидкой фазы (Vж = V2)в общем случае может быть больше или меньше объёма того же количества твердой фазы (Vт = V1). Отсюда в соответствии с уравнением (IV, 5) вытекает, что величина dP/dT или обратная ей величина dT/dP, характеризующая изменение температуры с увеличением давления, может быть положительной или отрицательной. Это значит, что температура плавления может повышаться или понижаться с увеличением давления.
Так, для бензола (tпл. = 5,4°C; 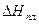 = 9986 Дж/моль; Vж = 87,28
= 9986 Дж/моль; Vж = 87,28 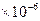 м3/моль; Vт = 86,27
м3/моль; Vт = 86,27 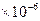 м3/моль)получаем по уравнению (IV, 5):
м3/моль)получаем по уравнению (IV, 5):
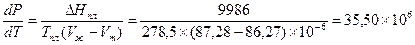 Па/К
Па/К
Обратная величина dT/dP = 0,0282 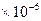 К/Па. Таким образом, с ростом давления температура плавления бензола повышается.
К/Па. Таким образом, с ростом давления температура плавления бензола повышается.
Величина dT/dP положительна для огромного большинства веществ. Она имеет отрицательное значение лишь для воды, висмута, галлия, германия и немногих других веществ, для которых плотность жидкости при температуре плавления больше плотности твердой фазы и (Vж – Vт) < 0.
Испарение.Теплота испарения – перехода жидкой фазы в газообразную – так же, как и теплота плавления, положительна. В этом случае всегда объём (удельный, мольный) газа больше соответствующего объёма жидкости, т. е. в уравнении (IV, 5) всегда V2 > V1. Поэтому dP/dT, а значит, и dT/dP также всегда положительны. Следовательно, температура испарения всегда повышается с ростом давления.
При температурах, далеких от критической, плотность насыщенного пара во много раз меньше плотности жидкости, а обратная величина – мольный (удельный) объём пара во много раз больше мольного (удельного) объёма жидкости. Поэтому значением V1 = Vжв уравнении (IV, 5) можно пренебречь, и оно примет вид:
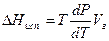 (IV, 6)
(IV, 6)
Если вдали от критической температуры насыщенный пар можно считать идеальным газом, то 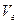 = RT/P,и из уравнения (IV, 5) получим[1]:
= RT/P,и из уравнения (IV, 5) получим[1]:
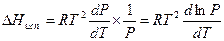 (IV, 7)
(IV, 7)
или
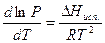 (IV, 8)
(IV, 8)
Теплота испарения жидкостей изменяется с температурой, не сильно убывая при средних температурах и очень сильно вблизи критической температуры, при которой 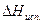 = 0. Например, для Н2О:
= 0. Например, для Н2О:
| t°C | |||||||||
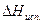 , кал/г , кал/г
| 594,7 | 584,1 | 567,9 | 539,1 | 463,4 | 335,1 | 213,0 | 107,0 | 35,3 |
Таблица 1. Энтальпия и энтропия испарения некоторых жидкостей при нормальной температуре кипения (Р = 1 атм.)
| Вещество | Tкип., K | 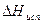 , кал/моль , кал/моль
| 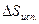 , кал/моль·K , кал/моль·K
|
| Водород | 20,4 | 10,6 | |
| Кислород | 90,1 | 18,0 | |
| Этиловый эфир | 21,1 | ||
| Бензол | 21,2 | ||
| Ртуть | 22,6 | ||
| Вода | 26,0 | ||
| Этиловый спирт | 26,9 |
Дата добавления: 2015-05-21; просмотров: 961;
