Метод электронного баланса
Данный метод основан на представлении о степени окисления атома в веществе. Степень окисления - это условный заряд атома, найденный исходя из предположения, что все связи в веществе чисто ионные. Степень окисления обозначается арабской цифрой со знаком (+) или (-).
Ионной связи в чистом виде в природе не существует. Например, в кристаллическом хлориде натрия (NaCl), натрий имеет реальный заряд +0,8 , а хлор (-0,8) заряда электрона по модулю. Отсюда следует, что степени окисления натрия (Na+) и хлора (Cl-) являются понятием формальным.
Тем не менее, метод электронного баланса в настоящее время широко используется, так как он наиболее прост и универсален. Практически единственным ограничением этого метода является то, что он позволяет уравнивать только полные схемы реакций.
Правила нахождения степеней окисления
Для применения метода электронного баланса необходимо знать степени окисления всех атомов в формулах веществ (исходных и продуктов реакции). Степени окисления находятся с использованием следующих правил:
1. Cтепень окисления атома в простом веществе равна нулю:
H 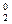 ; N
; N 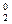 ; Mg
; Mg 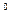 ; C
; C 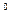 и т.д.
и т.д.
2. Сумма степеней окисления всех атомов в формульной единице вещества (молекуле) равна нулю.
K 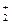 Cr
Cr 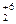 O
O 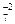 2 × (+1) + 2 × (+6) + 7 × (-2) = 0
2 × (+1) + 2 × (+6) + 7 × (-2) = 0
Чтобы воспользоваться этим правилом необходимо запомнить перечень химических элементов, атомы которых во всех (или почти во всех) их соединениях имеют одну и ту же степень окисления.
| Степень окисления атома элемента в соединениях | Исключения |
| Li+, Na+, K+, Rb+, Cs+, Fr+ | ¾¾¾ |
| Be+2, Mg+2, Ca+2, Sr+2, Ba+2, Ra+2 | ¾¾¾ |
| Al+3, Ga+3, Zn+3 | Al+, Ga+, Zn+ - очень редко |
| Ag+, Zn+2, Cd+2 | Ag+2 - очень редко |
| F- | ¾¾¾ |
| H+ | H- - в гидридах (NaH и т.п.) |
| O-2 | O- - в пероксидах (H2O2,, K2O2 и т.п.) O-1/2 - в надпероксидах (KO2 и т.п.) O-1/3 - в озонидах (KO3) O+, O+2 - во фторидах кислорода (O2F2, OF2) |
Возвратимся к приведенному выше примеру: K 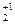 Cr
Cr 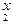 O
O 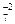 .
.
Cтепени окисления калия и кислорода найдены по таблице. Далее применяем правило электронейтральности молекулы: 2 × (+1) + 2 x + 7 × (-2) = 0. Отсюда: x = +6.
3. Степени окисления атомов в кислотных остатках такие же, как в соответствующих им кислотам. Это правило является следствием определения кислотного остатка: кислотный остаток - это часть молекулы кислоты, перешедшая в соль без изменений.
Пример: MnySxO  .
.
Вначале находим х. Кислотный остаток (сульфат) соответствует серной кислоте - H 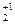 S+6O
S+6O  .
.
Теперь, по правилу электронейтральности молекулы можно найти степень окисления марганца: y + 6 + 4 (-2) = 0; y = +2.
Алгоритм применения метода электронного баланса
1. Написать схему реакции. Схема реакции - это условное химическое выражение, в котором слева указаны исходные вещества, справа - известные продукты реакции. Между правой и левой частями схемы ставится знак “стрелка”. Схема может быть полной (известны все продукты) и неполной (известна только часть продуктов). Метод электронного баланса позволяет работать только с полными схемами. Единственным веществом, которое можно не указывать в схеме является вода.
Пример: Cu + HNO3 ® Cu(NO3)2 + NO + . . . .
(многоточие означает, что в правой и левой части окончательного уравнения может появиться вода).
2. Над каждым атомом в схеме поставить степени окисления:
Cu0 + H+1N+5O  ® Cu+2(N+5O
® Cu+2(N+5O  )2 + N+2O-2 + . . . .
)2 + N+2O-2 + . . . .
3. Найти атомы, изменившие свои степени окисления. Составить для них уравнения электронных переходов:
Cu0 + H+1N+5O  ® Cu+2(N+5O
® Cu+2(N+5O  )2 + N+2O-2 + . . . .
)2 + N+2O-2 + . . . .
Cu0 - 2 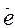 = Cu+2,
= Cu+2,
N+5 + 3 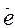 = N+2 .
= N+2 .
4. Сделать электронный баланс (подобрать коэффициенты, на которые нужно умножить уравнения электронных переходов, чтобы число электронов, ушедших от восстановителей, было равно количеству электронов, принятых окислителем).
 Cu0 - 2
Cu0 - 2 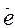 = Cu+2 3
= Cu+2 3
N+5 + 3 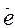 = N+2 2
= N+2 2
Из электронного баланса следует, что в левой части полученного уравнения на каждые 3 атома восстановителя (Cu+2) должно приходиться 2 атома окислителя (N+5). В правой части будущего уравнения на 3 атома Cu+2 должно приходиться 2 атома N+2.
5. В схеме реакции поставить первые коэффициенты в соответствии с электронным балансом (там, где это возможно !).
3Cu + HNO3 ® 3Cu(NO3)2 + 2NO + . . . .
Обратите внимание: из четырех теоретически возможных коэффициентов указаны только три. Перед азотной кислотой коэффициент пока неизвестен, т.к. N+5 ведет себя сложным образом: с одной стороны принимает участие в ОВР (это учтено в электронном балансе), а с другой - переходит без изменений в нитрат меди (Сu(NO3)2) (это не учтено в электронном балансе, т.к. при этом степень окисления азота не меняется).
6. Уравнять по всем атомам, кроме водорода и кислорода. При этом произвольное изменение коэффициентов, полученных из электронного баланса недопустимо.
3Cu + 8 HNO3 ® 3Cu(NO3)2 + 2NO + . . . .
7. Уравнять по водороду. Это делается только одним способом: добавлением соответствующего числа молекул воды в ту часть схемы, где водорода не хватает. В данном примере слева 8 атомов водорода, а справа - нуль. Молекула Н2О содержит 2 атома водорода:
3Cu + 8HNO3 ® 3Cu(NO3)2 + 2NO + 4H2O.
8. Полученное выражение должно быть уравнением ОВР, если до того не было допущено ошибки. Необходимо проверить данное уравнение по кислороду. Если справа и слева количество атомов кислорода одинаково, вместо “стрелки” ставим знак “равно” (это уравнение). Если по кислороду не сошлось, то следует повторить уравнивание, начиная с пункта 1.
Окончательное уравнение:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
Метод полуреакций (электронно-ионного баланса)
Данный метод применяется для составления уравнений ОВР в водных растворах с участием электролитов.
В этом методе не используется понятие степень окисления, а рассматривается обмен электронами между реальными частицами, присутствующими в растворе - ионами и молекулами. Метод полуреакций позволяет использовать в качестве исходных неполные схемы реакций.
К недостаткам этого метода следует отнести его некоторую громоздкость и ограниченность в применении только растворами электролитов.
Алгоритм применения метода полуреакций (электронно - ионного баланса)
1. Написать схему реакции. Схема может быть полной или неполной. В случае использования неполной схемы из продуктов реакции необходимо знать только частицу, в которую перешел окислитель и частицу, в которую перешел восстановитель в ходе ОВР.
Пример:
а) полная схема реакции:
Na2Cr2O7 + K2SO3 + H2SO4 ® Cr2(SO4)3 + K2SO4 + Na2SO4 + H2O;
б) неполная схема этой же реакции, достаточная для применения метода полуреакций:
Na2Cr2O7 + K2SO3 + H2SO4 ® Cr+3 + SO  + . . . .
+ . . . .
Пока для простоты будем использовать полную схему взаимодействия. Применение метода полуреакций к неполным схемам рассмотрено в конце этой главы.
2. Написать ионную схему реакции. При этом, на ионы разбиваются только сильные электролиты, хорошо растворимые в воде (как при составлении обменных ионных уравнений):
2Na+ + Cr2O 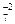 + 2K+ + SO
+ 2K+ + SO  + 2H+ + SO
+ 2H+ + SO  ®
®
2Cr+3 + SO  + 2K+ + SO
+ 2K+ + SO  + 2Na+ + SO
+ 2Na+ + SO  + H2O.
+ H2O.
П р и м е ч а н и е. Стехиометрические коэффициенты перед ионами можно не указывать. Они не имеют никакого смысла, так как данное выражение является схемой, а не уравнением реакции:
Na+ + Cr2O 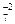 + K+ + SO
+ K+ + SO  + H+ + SO
+ H+ + SO  ®
®
Cr+3 + SO  + K+ +SO
+ K+ +SO  + Na+ + SO
+ Na+ + SO  + H2O.
+ H2O.
3. Сравнить правую и левую части ионной схемы и найти частицы, изменившие свою химическую форму. Под изменением химической формы подразумевается:
а) изменение заряда частицы;
б) изменение формульного состава частицы.
П р и м е ч а н и е. В данном пункте частицы H+ , OH- и H2O не рассматриваются.
SO  ® SO
® SO  (произошло изменение формульного состава частицы);
(произошло изменение формульного состава частицы);
Сr2O 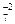 ® Cr+3 (произошло изменение как формульного состава, так и заряда частицы).
® Cr+3 (произошло изменение как формульного состава, так и заряда частицы).
4. Составить уравнения полуреакций окисления и восстановления. Это делается в такой последовательности.
а) уравниваются правые и левые части полуреакций по всем атомам, кроме кислорода и водорода:
SO  ® SO
® SO  ,
,
Cr2O 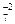 ® 2Cr+3,
® 2Cr+3,
б) полуреакции уравниваются по кислороду и водороду с учетом кислотности среды (далее будет рассмотрено отдельно)
SO  + H2O ® SO
+ H2O ® SO  + 2H+,
+ 2H+,
Cr2O 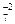 + 14 H+ ® 2Cr+3 + 7H2O,
+ 14 H+ ® 2Cr+3 + 7H2O,
в) полуреакции уравниваются по зарядам с помощью электронов. В первой полуреакции суммарный заряд частиц слева = -2, а справа = 0. Значит, справа нужно прибавить 2 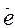 (или слева отнять 2
(или слева отнять 2 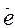 ):
):
SO  + H2O - 2
+ H2O - 2 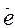 = SO
= SO  + 2H+ .
+ 2H+ .
Для уравнивания второй полуреакции слева нужно прибавить 6 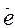 :
:
Cr2O 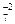 + 14H+ + 6
+ 14H+ + 6 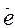 = 2Cr+3 + 7H2O.
= 2Cr+3 + 7H2O.
Полученные выражения являются уравнениями полуреакций.
5. Сделать электронный баланс, то есть подобрать коэффициенты, на которые необходимо умножить полуреакции окисления и восстановления, чтобы количество электронов, ушедших от восстановителя было равно числу электронов, пришедших к окислителю:

 SO
SO  + H2O - 2
+ H2O - 2 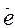 = SO
= SO  + 2H+ 3
+ 2H+ 3
Cr2O 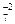 + 14H+ + 6
+ 14H+ + 6 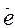 = 2Cr+3 + 7H2O 1
= 2Cr+3 + 7H2O 1
6. Умножить верхнее и нижнее уравнения полуреакций на коэффициенты электронного баланса. Затем сложить их и получить сокращенное ионное уравнение ОВР. В данном примере полуреакцию окисления нужно умножить на 3, а полуреакцию восстановления - на 1. После сложения получаем:
3SO  + 3H2O + Cr2O
+ 3H2O + Cr2O 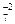 + 14H+ = 3SO
+ 14H+ = 3SO  + 6H+ + 2Cr+3 + 7H2O.
+ 6H+ + 2Cr+3 + 7H2O.
Далее сокращаем (по Н2О и Н+):
3SO  + Cr2O
+ Cr2O 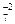 + 8H+ = 3SO
+ 8H+ = 3SO  + 2Cr+3 + 4H2O.
+ 2Cr+3 + 4H2O.
Данное выражение является сокращенным ионным уравнением взаимодействия между восстановителем (SO  ) и окислителем (Cr2O
) и окислителем (Cr2O 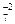 ) в кислой среде.
) в кислой среде.
Если необходимо получить молекулярное уравнение реакции, то следует выполнить еще один пункт.
7. Сокращенное ионное уравнение сложить с дополнительным ионным уравнением и получить полное ионное уравнение, которое затем преобразовать в молекулярное уравнение ОВР.
3SO  + Cr2O
+ Cr2O 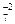 + 8H+ = 3SO
+ 8H+ = 3SO  + 2Cr+3 + 4H2O ,
+ 2Cr+3 + 4H2O ,
6K+ + 2Na+ + 4SO  = 6K+ + 3SO
= 6K+ + 3SO 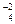 + 2Na+ + SO
+ 2Na+ + SO 
----------------------------------------------------------------------------
6K+ + 3SO  + 2Na+ + Cr2O
+ 2Na+ + Cr2O 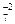 + 8H+ + 4SO
+ 8H+ + 4SO  =
=
= 6K+ + 3SO  + 2Cr+3 + 3SO
+ 2Cr+3 + 3SO  + 4H2O + 2Na+ + SO
+ 4H2O + 2Na+ + SO  .
.
3K2SO3 + Na2Cr2O7 + 4H2SO4 = Cr2(SO4)3 + 3K2SO4 + Na2SO4 + 4H2O.
П р и м е ч а н и е. В целях экономии времени полное ионное уравнение ОВР обычно не пишут, а при сложении сокращенного ионного с дополнительным ионным уравнением сразу же получают молекулярное уравнение.
Уравнивание полуреакций по кислороду и водороду с учетом
кислотности cреды
Как известно, в растворе среда может быть кислой, щелочной или нейтральной.
П р и м е ч а н и е. Если среда в растворе слабокислая (рН немного меньше 7) или слабо щелочная (рН немного больше 7) уравнивание производят, считая среду практически нейтральной.
I. Среда кислая (рН << 7). Для составления полуреакции разрешены частицы только 2-х видов: это ион Н+ и молекула Н2О.
Полезно запомнить следующую схему:
2H+ + O* ~ H2O.
По элементному составу 2 иона Н+ и один атом “связанного” кислорода (О*) эквивалентны одной молекуле воды. Под “связанным” кислородом понимается атом кислорода, входящий в состав любой кислородсодержащей частицы (например: в молекуле СО2 два “связанных” кислорода, а в ионе SO  - их четыре).
- их четыре).
Пример 1. SO  ® SO
® SO  .
.
Ион SO  содержит 3 О*, а ион SO
содержит 3 О*, а ион SO  содержит 4 О* . Чтобы уравнять по кислороду, слева следует добавить 1 молекулу Н2О. При этом справа должно появиться 2 иона Н+ (чтобы сошлось по водороду):
содержит 4 О* . Чтобы уравнять по кислороду, слева следует добавить 1 молекулу Н2О. При этом справа должно появиться 2 иона Н+ (чтобы сошлось по водороду):
SO  + H2O ® SO
+ H2O ® SO  + 2H+.
+ 2H+.
Пример 2. Cr2O 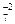 ® 2Cr+3.
® 2Cr+3.
Слева 7 атомов кислорода, а справа - ни одного. Слева добавляем 14 Н+ , при этом справа появляется 7 Н2О.
Пример 3. NO 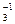 ® NH
® NH 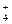 .
.
Cлева следует добавить 10 Н+. Из них 6 Н+ “свяжут” 3 кислорода в 3 молекулы воды, а 4 Н+ необходимы для получения иона аммония:
NO 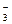 + 10 H+ ® NH
+ 10 H+ ® NH 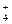 + 3H2O .
+ 3H2O .
П р и м е ч а н и е. Полученные в этих примерах схемы полуреакций не являются уравнениями. Далее их следует уравнять по зарядам с помощью электронов.
II. Среда щелочная (рН >> 7). В данном случае для уравнивания по кислороду и водороду можно использовать только ионы ОН- и молекулы Н2О. Между этими частицами имеет место следующее соотношение (по элементному составу):
2OH- ~ H2O + O*.
Пример 1. SO  ® SO
® SO  ,
,
SO  + 2OH- ® SO
+ 2OH- ® SO  + H2O.
+ H2O.
Пример 2. CrO  ® Cr+3,
® Cr+3,
CrO  + 4H2O ® Cr+3 + 8OH-.
+ 4H2O ® Cr+3 + 8OH-.
Пример 3. MnO2 ® MnO  ,
,
MnO2 + 4OH- ® MnO  + 2H2O.
+ 2H2O.
Пример 4. N2H4 ® N2,
N2H4 + 4OH- ® N2 + 4H2O.
III. Среда нейтральная (рН » 7). Для уравнивания по кислороду и водороду в схеме полуреакции слева можно писать только Н2О. Справа могут появиться или Н+ или OH-.
Пример 1. SO  ® SO
® SO  ,
,
SO  + H2O ® SO
+ H2O ® SO  + 2H+.
+ 2H+.
Обратите внимание: в данном случае схема реакции совпадает с таковой для случая кислой среды.
Пример 2. NO 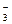 ® NO
® NO 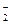 ,
,
NO 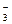 + H2O ® NO
+ H2O ® NO 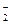 + 2OH- .
+ 2OH- .
Полученное выражение аналогично переходу нитрата в нитрит в щелочной среде.
Применение метода полуреакций для неполных схем
Рассмотрим следующий пример: к раствору KMnO4 добавили несколько капель H2SO4 (т.е. создали кислую среду), а затем добавили раствор Na2SO3 . Составить уравнение ОВР. Условие задачи можно записать в виде схемы:
KMnO4 + Na2SO3 + H2SO4 ® . . . .
или в ионном виде:
K+ + MnO 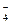 + 2Na+ + SO
+ 2Na+ + SO  + 2H+ + SO
+ 2H+ + SO  ® . . . .
® . . . .
Из литературы известно, что ион MnO 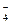 является довольно сильным окислителем в любых средах. В кислой среде (в нашем случае) имеет место переход: MnO
является довольно сильным окислителем в любых средах. В кислой среде (в нашем случае) имеет место переход: MnO 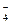 ® Mn+2.
® Mn+2.
Так же известно, что SO  в любых средах склонен проявлять восстановительные свойства. Причем, независимо от cреды сульфит переходит в сульфат: SO
в любых средах склонен проявлять восстановительные свойства. Причем, независимо от cреды сульфит переходит в сульфат: SO  ® SO
® SO  .
.
Напишем уравнения соответствующих полуреакций и сделаем электронный баланс:
 MnO
MnO 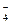 + 8H+ + 5
+ 8H+ + 5 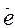 = Mn+2 + 4H2O 2
= Mn+2 + 4H2O 2
SO  + H2O - 2
+ H2O - 2 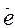 = SO
= SO  + 2H+ 5
+ 2H+ 5
Умножим уравнения полуреакций на коэффициенты электронного баланса и сложим. После сокращения одинаковых ионов получим сокращенное ионное уравнение ОВР:
2MnO 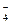 + 16 H+ + 5H2O = 2Mn+2 + 8H2O + 5SO
+ 16 H+ + 5H2O = 2Mn+2 + 8H2O + 5SO  + 10 H+,
+ 10 H+,
2MnO 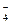 + 6 H+ + 5SO
+ 6 H+ + 5SO  = 2Mn+2 + 3H2O + 5SO
= 2Mn+2 + 3H2O + 5SO  .
.
Напишем снизу дополнительное ионное уравнение:
2MnO 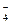 + 6 H+ + 5SO
+ 6 H+ + 5SO  = 2Mn+2 + 3H2O + 5SO
= 2Mn+2 + 3H2O + 5SO  .
.
2K+ + 3SO  + 10Na+ = 2SO
+ 10Na+ = 2SO  + 10Na+ + 2K+ + SO
+ 10Na+ + 2K+ + SO  .
.
Далее получаем молекулярное уравнение ОВР:
2KMnO4 + 3H2SO4 + 5Na2SO3 = 2MnSO4 + 3H2O + 5Na2SO4 + K2SO4.
Дата добавления: 2015-04-29; просмотров: 1955;
