Произведение растворимости
Произведение растворимости (ПР) является частным случаем константы равновесия для процесса перехода труднорастворимого сильного электролита в раствор.
Рассмотрим пример: в емкость с водой поместили кристаллический хлорид серебра (AgCl). Абсолютно нерастворимых веществ в природе не существует. Поэтому, несмотря на очень плохую растворимость, хлорид серебра начинает переходить в воду, причем в виде ионов Ag+ и Cl- (т.к. любая соль - сильный электролит). Растворение AgCl будет происходить до тех пор, пока не установится равновесие:
AgCl(тв)  Ag+ + Cl- (в растворе)
Ag+ + Cl- (в растворе)
После установления такого равновесия раствор будет называться насыщенным. Для данного обратимого процесса можно ввести константу равновесия:
Kp =  ,
,
где [Ag+]p и [Cl-]p - молярные концентрации соответствующих ионов в равновесном (насыщенном) растворе.
Концентрация [AgClm] является постоянной величиной. По сути дела это плотность твердого хлорида серебра, выраженная в единицах молярной концентрации (моль / дм3 = М). Поэтому вводится новая константа равновесия, которая называется произведением растворимости (ПР):
ПР(AgCl) = Kp × [ AgCl(m) ] = [Ag+]p × [Cl-]p.
ПР зависит только от природы веществ (электролита и воды) и температуры. ПР определяет произведение концентраций в насыщенном растворе. Если в каком-либо растворе произведение концентраций ПК = [Ag+] [Cl-] меньше ПР, то такой раствор является ненасыщенным. В нем можно растворить еще некоторое количество данного вещества (до насыщения: ПК = ПР).
Если же ПК > ПР, то раствор называется пересыщенным. Это тоже неравновесный раствор, так как избыточное количество растворенного вещества будет самопроизвольно выпадать в виде осадка до тех пор, пока ПК не станет равным ПР при этой температуре.
Задача. Выпадет ли осадок, если смешать 1 дм3 раствора AgNO3 с концентрацией 0,01 М и 1 дм3 раствора K2SO4 с концентрацией 0,2 M ? ПР (Ag2SO4) = 2 × 10-5 ?
Решение: Взаимодействие должно протекать по уравнению:
2AgNO3 + K2SO4 = Ag2SO4¯ + 2KNO3.
Но осадок сульфата серебра начнет выпадать только при:
ПК = [Ag+]2 [SO4]  > ПР = 2 × 10-5 .
> ПР = 2 × 10-5 .
Найдем [Ag+]. В 1 дм3 исходного раствора AgNO3 содержалось 0,01 моль соли, а значит и 0,01 моль Ag+ , так как AgNO3 - сильный электролит и диссоциирует полностью:
AgNO3 = Ag+ + NO 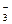
0,01 моль 0,01 моль 0,01 моль
Так как растворы очень разбавлены, то сумма их объемов равна объему смеси (1 дм3 + 1 дм3 = 2 дм3).
Отсюда [Ag+] = 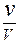 = 0,01 моль / 2 дм3 = 0,005 М (после смешивания). Аналогично можно найти концентрацию ионов SO
= 0,01 моль / 2 дм3 = 0,005 М (после смешивания). Аналогично можно найти концентрацию ионов SO 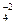 в смеси: [SO
в смеси: [SO 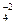 ] = 0,2 моль / 2 дм3 = 0,1 М.
] = 0,2 моль / 2 дм3 = 0,1 М.
Найдем ПК = [Ag+]2 [SO 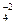 ] = 2,5 × 10-6.
] = 2,5 × 10-6.
2,5 × 10-6 = ПК < ПР = 2 × 10-5.
Ответ: осадок выпадать не будет.
Дата добавления: 2015-04-29; просмотров: 1539;
