Гидролиз солей
Гидролиз - это обменное взаимодействие между частицами вещества, растворенного в воде и молекулами растворителя (воды).
Гидролизу могут подвергаться как органические, так и неорганические вещества. Наиболее практически важен гидролиз солей.
Любая соль является сильным электролитом, поэтому в водном растворе она существует только в виде ионов - катионов основного остатка и анионов кислотного остатка. Отсюда следует, что гидролиз соли сводится к обменному взаимодействию между ионами (катионами или анионами) и молекулами воды. Различают 3 случая гидролиза; гидролиз по катиону, гидролиз по аниону и совместный гидролиз по катиону и аниону одновременно.
А. Гидролиз по катиону
Гидролиз по катиону имеет место только в том случае, если в результате его протекания в растворе появляются частицы слабых электролитов (слабые основания или их основные остатки - гидроксокатионы). Так, например, сульфат натрия Na2SO4 не подвергается гидролизу по катиону (NaOH - сильный электролит), в то время как сульфат меди (II) CuSO4 гидролизуется по катиону.
При переходе в водный раствор CuSO4 полностью распадается на ионы:
CuSO4 = Cu+2 + SO 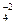
Далее идет гидролиз иона Сu+2 по двум ступеням (первая ступень - гидролиз самого иона Cu+2, а вторая ступень - гидролиз его гидрокатиона):
I ступень гидролиза: Cu+2 + H2O  CuOH+ + H+.
CuOH+ + H+.
II ступень гидролиза: CuOH+ + H2O  Cu(OH)2 + H+
Cu(OH)2 + H+
Cуммарное уравнение: Cu+2 + 2H2O  Cu(OH)2 + 2H+
Cu(OH)2 + 2H+
Данные уравнения написаны в ионном виде. Можно написать и молекулярные уравнения гидролиза, хотя эта форма записи носит формальный характер, так как гидролиз соли - ионное взаимодействие:
I ступень: 2CuSO4 + 2H2O  (CuOH)2SO4 + H2SO4
(CuOH)2SO4 + H2SO4
II ступень: (CuOH)2SO4 + 2H2O  Cu(OH)2 + H2SO4 .Суммарное уравнение: CuSO4 + 2H2O
Cu(OH)2 + H2SO4 .Суммарное уравнение: CuSO4 + 2H2O  Cu(OH)2 + H2SO4 .
Cu(OH)2 + H2SO4 .
Из рассмотренного примера следует, что при гидролизе по катиону cреда всегда становится кислой (рН < 7). Исходя из принципа Ле-Шателье можно сделать вывод о том, что гидролиз по второй ступени протекает значительно слабее, чем по первой. Так как гидролиз уже по первой ступени в большинстве случаев является процессом маловыраженным (равновесие смещено влево), то во многих случаях вторую (и последующие) ступени гидролиза не учитывают. По этой же причине при слабом гидролизе довольно бессмысленным является и суммарное уравнение.
Следует обратить внимание на тот факт, что гидролиз по сути является реакцией, обратной нейтрализации (взаимодействие между кислотой и основанием). Любая реакция нейтрализации является экзотермическим процессом. Поэтому обратная ей реакция (гидролиз) всегда эндотермична. Из-за этого любой гидролиз усиливается при нагревании раствора и ослабляется при его охлаждении.
Б. Гидролиз по аниону
Анионы подвергаются гидролизу только в том случае, если в результате реакции образуются частицы слабых электролитов (слабые кислоты или их кислотные остатки - гидроанионы). Подобно гидролизу по катиону, гидролиз по аниону является процессом обратимым, причем равновесие в большинстве случаев заметно сдвинуто влево.
Для примера рассмотрим гидролиз карбоната натрия, который при переходе в водный раствор диссоциирует по уравнению:
Na2CO3 = 2Na+ + CO 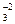
Далее идет гидролиз по 2 ступеням (в ионном виде):
I cтупень: CO 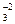 + H2O
+ H2O  HCO
HCO 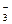 + OH-
+ OH-
II ступень: HCO 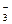 + H2O
+ H2O  H2CO3 + OH-
H2CO3 + OH-
Суммарное уравнение: CO 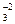 + 2H2O
+ 2H2O  H2CO3 + 2OH-
H2CO3 + 2OH-
То же самое в молекулярном виде:
I ступень: Na2CO3 + H2O  NaHCO3 + NaOH
NaHCO3 + NaOH
II ступень: NaHCO3 + H2O  H2CO3 + NaOH .
H2CO3 + NaOH .
Cуммарное уравнение: Na2CO3 + 2H2O  H2CO3 + 2NaOH
H2CO3 + 2NaOH
Главный вывод: при гидролизе по аниону среда всегда становится щелочной (рН > 7).
Все остальные рассуждения аналогичны тем, что были приведены при рассмотрении гидролиза по катиону:
1) вторая и последующие ступени протекают значительно слабее первой.
2) нагревание всегда усиливает любой гидролиз, а охлаждение - ослабляет.
В. Совместный гидролиз
В отличие от двух предыдущих случаев, совместный гидролиз является процессом, равновесие которого сильно смещено вправо. Часто гидролиз такого типа является даже практически необратимой реакцией.
Для протекания совместного гидролиза необходимо, чтобы в растворе одновременно находились гидролизующиеся катионы и гидролизующиеся анионы. Такая ситуация может возникнуть в 2 случаях:
a) если соль слабого основания и слабой кислоты растворить в воде (такое встречается нечасто, т.к. подавляющее большинство таких солей в воде растворимы очень плохо);
б) если смешать растворы двух солей, один из которых содержит гидролизующиеся катионы, а второй - гидролизующиеся анионы.
Соли слабых оснований и кислот, подвергающиеся полному гидролизу можно найти в таблице растворимости - они там обозначены прочерками. (Внимание: прочерк может соответствовать так же не существующему соединению, например СuJ2).
Рассмотрим явления, имеющие место при растворении силиката олова (II) SnSiO3 :
SnSiO3 = Sn+2 + SiO 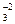
| Cтупени | Гидролиз по катиону | Гидролиз по аниону |
| I | Sn+2 + H2O  SnOH+ + H+ SnOH+ + H+
| SiO 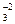 + H2O + H2O  HSiO HSiO 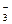 + OH- + OH-
|
| II | SnOH+ + H2O  Sn(OH)2 + H+ Sn(OH)2 + H+
| HSiO 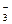 + H2O + H2O  H2SiO3 + OH- H2SiO3 + OH-
|
В ходе гидролиза по катиону в растворе появляются избыточные ионы водорода, а при гидролизе по аниону - избыточные гидроксоанионы. Эти ионы практически мгновенно вступают в реакцию нейтрализации:
H+ + OH- = H2O
За счет реакции нейтрализации равновесие всех четырех реакций гидролиза резко смещается вправо (по принципу Ле-Шателье). В результате совместный гидролиз данной соли протекает практически необратимо, с образованием кремниевой кислоты и гидроксида олова (II):
SnSiO3 + 2H2O = Sn(OH)2¯ + H2SiO3¯
Подобные процессы происходят, если смешать растворы AlCl3 и Na2CO3. После смешивания в растворе начинается совместный гидролиз (ионов Al+3 и CO 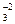 ), который приводит к выделению углекислого газа (разложение угольной кислоты) и появлению осадка гидроксида алюминия.
), который приводит к выделению углекислого газа (разложение угольной кислоты) и появлению осадка гидроксида алюминия.
2Al+3 + 3CO 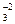 + 3H2O = 2Al(OH)3 ¯ + 3CO2
+ 3H2O = 2Al(OH)3 ¯ + 3CO2
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3¯ + 3CO2 + 6NaCl
Дата добавления: 2015-04-29; просмотров: 2655;
