Электродные потенциалы
Если кусочек металла погрузить в водный раствор его соли, то металл относительно раствора приобретет некий потенциал (называемый электродным потенциалом). При этом в системе установится равновесие между гидратированными ионами металла Me+z в растворе и атомами металла в твердой фазе:
Me+z (aq) + ze-  Me(тв)
Me(тв)
В данной системе кусок металла является электродом (активным электродом, т.к. частицы, из которых он состоит могут обратимо переходить в раствор в виде ионов).
Величина электродного потенциала зависит от многих факторов. В специальных таблицах приведены значения стандартных электродных потенциалов (E°), измеренных при стандартных условиях (T = 298 K, p = 1,013.105 Па, концентрация ионов [Me+z] = 1 моль/л).
Если условия отличаются от стандартных, то электродный потенциал (E) электрода можно рассчитать по уравнению Нернста:
E = E° + 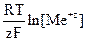 ,
,
где: E° - стандартный электродный потенциал,
T - температура,
R - универсальная газовая постоянная,
F - постоянная Фарадея (96 485 Кл/моль),
z - количество электронов, принимающих участие в элементарном окислительно-восстановительном акте на электроде.
Величина электродного потенциала определяет термодинамическую возможность и направление протекания ОВР на данном электроде в электрохимической системе.
Дата добавления: 2015-04-29; просмотров: 929;
