Электролиз. Электролизом называются окислительно-восстановительные реакции, протекающие при прохождении электрического тока через жидкость
Электролизом называются окислительно-восстановительные реакции, протекающие при прохождении электрического тока через жидкость, содержащую ионы. Ионы могут появиться в жидкой среде при растворении электролита в полярном растворителе (электролитическая диссоциация) или при переходе ионогена в жидкое состояние (термическая ионизация).
Электролиз сводится к разрядке ионов на соответствующих электродах. При электролизе анод имеет положительный заряд, а катод - отрицательный (сравните с гальваническим элементом !).
Пример 1: электролиз расплава хлорида натрия. Жидкий NaCl состоит из ионов Na+ и Cl- Если в этот расплав погрузить два электрода и пропускать электроток от внешнего источника, то на электродах будет протекать ОВР разложения соли:
2Na+ + 2Cl- 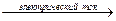 2Na + Cl2
2Na + Cl2
анод (+) 2Cl- - 2e- = Cl2
катод (-) 2Na+ + 2e- = 2Na
Данный пример является простейшим, так как в токопроводящей жидкости присутствуют катионы одного вида и анионы одного вида. Других частиц, способных к разрядке в данной среде нет.
Пример 2 : электролиз водного раствора хлорида натрия. В этой системе кроме ионов Na+ и Cl- присутствуют ионы H+ и OH- (автоионизация воды):
H2O 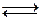 H+ + OH-
H+ + OH-
В данном растворе присутствуют 2 частицы, теоретически способных к восстановлению и 2 частицы, в принципе способных к окислению. В такой ситуации пользуются правилами:
1) на аноде более вероятен тот процесс, для которого электродный потенциал меньше;
2) на катоде более вероятен тот процесс, для которого электродный потенциал больше.
Среда в рассматриваемом растворе нейтральная ([H+] = [OH-] = 10-7 моль/л). Если концентрация NaCl растворе 1 моль/л, то электродные потенциалы (E) четырех возможных процессов (полуреакций) будут следующими:
возможные анодные процессы
2Cl-- 2e- = Cl2 E1 = E° = + 1,36 В
2H2O - 4e- = 4H+ + O2 E2 » + 2 В (E2 больше стандартного значения для этой полуреакции E° = + 1,23 В засчет явления перенапряжения);
возможные катодные процессы
Na+ + e- = Na E3 = E° = - 2,71 В
2H+ + 2e- = H2 E4 = - 0,41 В (E4 меньше стандартного значения для этой полуреакции E° = 0 В засчет того, что [H+] = 10-7 моль/л) .
Сравнение величин электродных потенциалов приводит к выводу о том, что электролиз водного раствора хлорида натрия будет протекать по схеме:
анод (+) 2Cl-- 2e- = Cl2
катод (-) 2H+ + 2e- = H2
2 NaCl + 2H2O 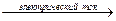 Cl2 + H2 + 2 KOH
Cl2 + H2 + 2 KOH
На аноде будет выделяться газообразный хлор, на катоде - газообразный водород, в растворе будет накапливаться щелочь (гидроксид калия).
В примере №2 электродные потенциалы конкурирующих полуреакций (E1 и E2 , E3 и E4 ) существенно отличны (|E1-E2|=0,64В, |E3-E4|=2,29В). Если абсолютное значения модуля разности конкурирующих полуреакций не превышает 0,2-0,3В, то в этом случае обычно наблюдается параллельное протекание нескольких процессов на данном электроде. Кроме того, в ряде случаев следует учитывать изменение электродных потенциалов в ходе электролиза (по уравнению Нернста), так как реагенты, принимающие участие в процессах на электродных расходуются и их концентрация постепенно уменьшается.
Массу вещества (m), выделившегося на электроде в ходе электролиза можно рассчитать по закону Фарадея:
m = 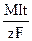 ,
,
где I - сила тока (A),
t - время (с)
F - постоянная Фарадея (96485 Кл/моль)
M - молярная масса вещества (г/моль).
z - число электронов, принимающих участие в образовании одной молекулы (или одной формульной единицы) вещества.
Физико-химический смысл постоянной Фарадея: F равна заряду 1 моля электронов.
Дата добавления: 2015-04-29; просмотров: 954;
