Новая теория электролиза воды и её экспериментальная проверка
Вооружившись полученной информацией, приступим к поиску новой теории существующего процесса электролиза воды. Эта теория должна ответить, прежде всего, на следующий вопрос: почему теоретические расчеты показывают наличие дополнительной тепловой энергии при низковольтном электролизе воды, а существующие промышленные электролизеры не генерируют её?
Поскольку атомарный водород существует лишь при температуре 2700-10000 С, а в обычных электролизёрах такой температуры нет, то это значит, что при электролизе воды отсутствует процесс синтеза молекул водорода из его свободных атомов и сразу возникает вопрос откуда берутся молекулы водорода при электролизе воды? Почему наши предшественники не поставили этот вопрос? Мешало орбитальное движение электронов в атомах, которое лишало возможности формирования правильных представлений о процессах соединения атомов в молекулы. Теперь мы знаем, что электроны взаимодействуют с протонами ядер не орбитально, а линейно [51]. Отсутствие орбитального движения электронов в атомах и их линейное взаимодействие с протонами ядер раскрывает структуры любых атомов, в том числе и атомов водорода (рис. 4) и кислорода (рис. 49, b), которые входят в состав молекулы воды.
Отметим ещё раз: атомарный водород (рис. 4) существует в плазменном состоянии при температуре 2700-10000 С. Если бы образование молекул водорода при электролизе воды шло путем отделения его атомов от молекул воды, то в фазе атомарного состояния водорода в электролитическом растворе должна формироваться указанная температура, но её нет, поэтому у нас появляются основания предположить, что молекулы водорода и кислорода выделяются из кластеров воды в синтезированном состоянии. Плодотворность этого предположения подтверждают структуры атома кислорода (рис. 49, b) и молекулы воды (рис. 50).

Рис. 49. Схемы ядра и атома кислорода
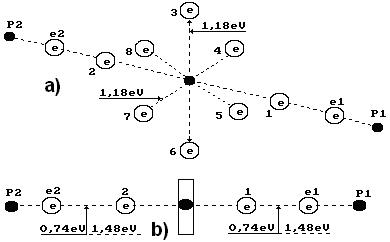
Рис. 50. Схема молекулы воды: 1,2,3,4,5,6,7,8 - номера электронов атома кислорода;
 - ядра атомов водорода (протоны);
- ядра атомов водорода (протоны);  и
и  - номера электронов атомов водорода
- номера электронов атомов водорода
Два электрона 1 и 2 атома кислорода (рис. 49, b) расположены на оси атома, а шесть остальных – по кругу, перпендикулярному оси. Можно предположить, что суммарное электростатическое поле шести электронов, расположенных по кругу (назовем их кольцевыми электронами), удаляет первый и второй осевые электроны на большее расстояние от ядра атома, чем то расстояние от ядра атома, на котором распложены кольцевые электроны. Поэтому осевые электроны атома кислорода являются его главными валентными электронами. Именно к этим электронам и присоединяются электроны атомов водорода, и образуется молекула воды (рис. 50) [51].
Символами 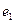 и
и 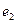 обозначены электроны атомов водорода, а символами
обозначены электроны атомов водорода, а символами 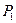 и
и 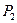 - протоны атомов водорода. Структура атома водорода (рис. 4) показывает, что если этот атом соединится с первым осевым электроном атома кислорода своим единственным электроном, то протон окажется на поверхности молекулы и образует зону с положительным зарядом, который будет генерироваться протоном атома водорода. Аналогичную зону сформирует и протон второго атома водорода, который соединяется со вторым осевым электроном атома кислорода (рис. 49). Отрицательно заряженную зону сформируют электроны атома кислорода, расположенные по кольцу вокруг оси атома кислорода [51].
- протоны атомов водорода. Структура атома водорода (рис. 4) показывает, что если этот атом соединится с первым осевым электроном атома кислорода своим единственным электроном, то протон окажется на поверхности молекулы и образует зону с положительным зарядом, который будет генерироваться протоном атома водорода. Аналогичную зону сформирует и протон второго атома водорода, который соединяется со вторым осевым электроном атома кислорода (рис. 49). Отрицательно заряженную зону сформируют электроны атома кислорода, расположенные по кольцу вокруг оси атома кислорода [51].
Поскольку при охлаждении электроны излучают фотоны и приближаются к ядру атома, то шесть кольцевых электронов атома кислорода в молекуле воды (рис. 50), приближаясь к ядру атома, своим статическим полем удаляют осевые электроны от ядра. В этом случае расстояние между атомами водорода, расположенными на оси молекулы воды, увеличиваются. Это главная причина увеличения размеров молекул воды при их замерзании.
Обратим внимание на то, что кластеры воды формируются, прежде всего, протон - протонными связями, когда две её молекулы соединяются соосно. Если учесть, что размер протона на три порядка меньше размера электрона, то протон – протонная связь легче разрушается при механическом воздействии на такой кластер (рис. 51, а). Второй вариант образования кластера – соединение осевого протона одной молекулы воды с кольцевым электроном другой молекулы воды. Это – протон – электронная связь (рис. 51, b). Её прочность тоже меньше прочности электрон - электронной связи. Эти факты и проясняют текучесть воды.
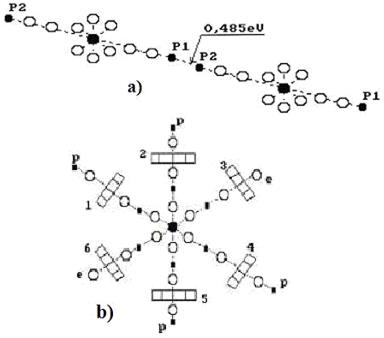
Рис. 51. Кластеры молекул воды: а) - линейный кластер воды;
b) шести лучевой кластер воды
Молекулы воды формируют кластеры различных форм. При определённых условиях и определённой температуре (в зимних облаках) шесть молекул воды присоединяются своими протонами атомов водорода к кольцевым электронам атома кислорода другой молекулы воды. В результате образуется шести лучевая структура, которая с увеличением размера и усложнением формирует ажурную шести лучевую структуру – снежинку. Этот естественный процесс реализуется при строго определённых энергиях связи валентных электронов, которые зависят от энергий поглощаемых и излучаемых фотонов.
Большое электрическое сопротивление воды обусловлено тем, что на осевых концах молекул располагаются положительно заряженные протоны атомов водорода. В результате линейные кластеры молекул воды имеют на обоих концах одноимённые заряды, что исключает возможность формирования электрической цепи в чистой воде.
Чтобы уменьшить электрическое сопротивление воды и увеличить её электропроводность, надо ввести в раствор ионы, которые имели бы на одном конце главной оси электрон, а на другом протон. В этом случае такие ионы легко объединяются в линейные кластеры с разными знаками электрических зарядов на их концах, что и приводит к формированию электрических цепей в растворе, которые увеличивают его электропроводность. В качестве примера можно рассмотреть присутствие в воде иона 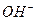 (рис. 52).
(рис. 52).
Известно, что вода может обладать щелочными или кислотными свойствами. Щелочные свойства формируются за счет увеличенного содержания в воде гидроксила 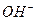 [1].
[1].
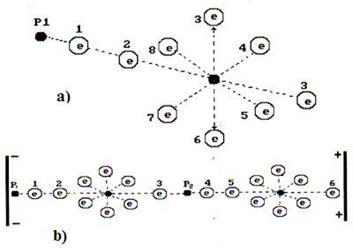
Рис. 52. Схемы: а) гидроксила 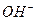 ; b) кластера
; b) кластера 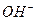
На рис. 52, а представлена схема гидроксила 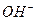 . На одном конце оси гидроксила расположен электрон атома кислорода, а другой - завершается протоном атома водорода. Таким образом, гидроксил – идеальное звено электрической цепи. Под действием приложенного напряжения эти ионы формируют линейные кластеры с положительным и отрицательным знаками электрических зарядов на концах (рис. 52, b). В результате электрический импульс напряжения передаётся вдоль этого кластера [1] .
. На одном конце оси гидроксила расположен электрон атома кислорода, а другой - завершается протоном атома водорода. Таким образом, гидроксил – идеальное звено электрической цепи. Под действием приложенного напряжения эти ионы формируют линейные кластеры с положительным и отрицательным знаками электрических зарядов на концах (рис. 52, b). В результате электрический импульс напряжения передаётся вдоль этого кластера [1] .
Конечно, ток не течёт вдоль кластера. Он формируется благодаря тому, что ион гидроксила 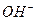 , расположенный на конце кластера у анода (рис. 52, b) отдаёт ему свой электрон, а протон атома водорода у иона
, расположенный на конце кластера у анода (рис. 52, b) отдаёт ему свой электрон, а протон атома водорода у иона 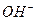 , расположенного у катода, получает электрон из сети.
, расположенного у катода, получает электрон из сети.
Если к этому добавить тот факт, что водород выделяется у катода (-), а кислород у анода, то факт движения электронов от анода (+) к катоду (-) во внешней цепи, соединяющей анод и катод, который мы уже описали, становится неоспоримым. На каком основании электротехники считают, что электроны в цепи постоянного тока движутся от минуса (-) к полюсу (+) остаётся тайной. Поэтому мы будем придерживаться уже описанного нами неоспоримого экспериментального факта о движении электронов в цепи постоянного тока от плюса (+) к минусу (-).
Известно, что молекулы водорода могут существовать в двух формах, которые называются ортоводородом и параводородом (рис. 53).
Итак, процесс электролиза начинается с выхода электрона  из катода в раствор. Осевые протоны
из катода в раствор. Осевые протоны 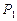 двух молекул воды (рис. 54, а и b), получив от катода по электрону
двух молекул воды (рис. 54, а и b), получив от катода по электрону 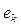 , соединяются в кластер, в структуре которого оказывается молекула ортоводорода (рис. 54, а) в синтезированном состоянии.
, соединяются в кластер, в структуре которого оказывается молекула ортоводорода (рис. 54, а) в синтезированном состоянии.
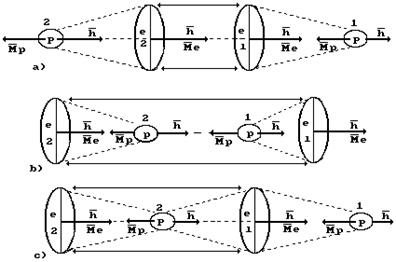
Рис. 53. Схема молекулы водорода  : а), b) - ортоводород; c) - параводород
: а), b) - ортоводород; c) - параводород
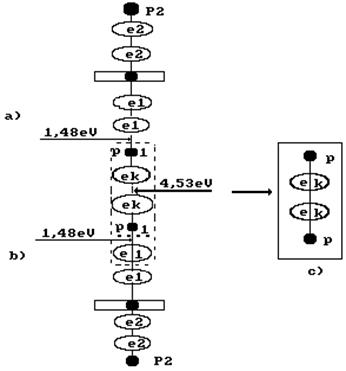
Рис. 54. Схема формирования молекулы ортоводорода в структуре кластера из двух
молекул воды
Теперь надо организовать такое импульсное воздействие на этот кластер, чтобы образовавшаяся молекула ортоводорода выделилась в свободное состояние (рис. 53, с). Обратим внимание на то, что на образование молекулы водорода в этом процессе расходуется два электрона  , пришедшие из катода, то есть из сети.
, пришедшие из катода, то есть из сети.
В соответствии с законом Фарадея, на образование одного моля водорода в этом случае расходуется два Фарадея Кулонов электричества 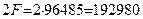 или
или 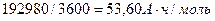 [1].
[1].
Если электролиз идет при напряжении 1,70V, то на получение одного моля водорода будет израсходовано 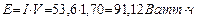 , а на получение
, а на получение 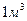 -
-
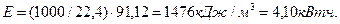 (66)
(66)
Как видно, расчеты с использованием закона Фарадея дают результат, совпадающий с расходом электроэнергии на получение одного кубического метра водорода из воды лучшими современными электролизёрами.
В Природе, например, при фотосинтезе, как мы уже отметили, этот показатель многократно меньше, поэтому перед нами естественный вопрос: как уменьшить затраты энергии но получение водорода из воды?
Для этого нам необходима информация об энергиях химических связей электронов атомов водорода и кислорода с их ядрами в момент пребывания электронов на любом энергетическом уровне (табл. 8 и 9).
В ряду энергий связей электрона с протоном атома водорода (табл. 8) и валентного электрона атома кислорода с протоном его ядра (табл. 9) есть энергии связи (1,51eV) и (1,53 eV), при которых начинается и идет процесс выделения газов в процессе электролиза воды, согласно старой теории этого процесса.
Эти энергии соответствуют пребыванию электронов на третьих энергетических уровнях. Раньше, из анализа процесса синтеза молекулы воды, мы установили, что энергия связи между электронами атомов водорода и кислорода в молекуле воды равна 1,48eV (рис. 50, b).
Таблица 8. Спектр атома водорода
| Значения | n | |||||
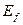 (эксп) (эксп)
| eV | 10,20 | 12,09 | 12,75 | 13,05 | 13,22 |
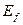 (теор) (теор)
| eV | 10,198 | 12,087 | 12,748 | 13,054 | 13,220 |
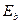 (теор) (теор)
| eV | 3,40 | 1,51 | 0,85 | 0,54 | 0,38 |
Таблица 9. Спектр первого электрона атома кислорода
| Значения | n | |||||
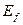 (эксп.) (эксп.)
| eV | 10,18 | 12,09 | 12,76 | 13,07 | 13,24 |
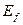 (теор.) (теор.)
| eV | 10,16 | 12,09 | 12,76 | 13,07 | 13,24 |
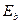 (теор.) (теор.)
| eV | 3,44 | 1,53 | 0,86 | 0,55 | 0,38 |
Итак, среди энергий связи электрона атома водорода с его ядром (протоном) есть энергия (1,51 eV), близкая к экспериментальному значению (1,48 eV). Определим аналогичные энергии для электронов атома кислорода.
Поскольку в химических реакциях участвуют, в основном, поверхностные электроны атомов, которые имеют близкие значения энергий связи с ядрами атомов на одноименных энергетических уровнях, то ограничимся анализом энергий связи первого электрона атома кислорода (табл. 9).
Как видно (табл. 9), энергии связи первого электрона атома кислорода практически совпадают с соответствующими энергиями связи электрона атома водорода (табл. 8). Причем, энергия, соответствующая третьему уровню (1,53 eV), близка к экспериментальному значению энергии (1,48 eV) газовыделения при низковольтном электролизе воды. Так что теоретические значения энергий связи электрона первого атома водорода и первого электрона атома кислорода в молекуле воды, полученные на основании закона формирования спектров, представленного в нашей монографии [1], близки к экспериментальным значениям этой энергии (табл. 9).
Теперь у нас появились веские основания полагать, что первый электрон атома кислорода, устанавливая связь с первым атомом водорода в молекуле воды, находится вблизи третьего ( 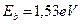 ) энергетического уровня (табл. 8).
) энергетического уровня (табл. 8).
Анализируя закономерность изменения энергий связи электронов атома кислорода и других атомов с их ядрами, мы установили, что в условиях присутствия в атоме всех электронов они имеют, примерно, одинаковые энергии связи с ядрами атомов. Поэтому будем считать, что симметричность молекулы воды обеспечивает равные (или близкие) энергии связи с ядром его первого и второго электронов.
Низковольтный процесс электролиза воды обычно идет при напряжении (1,6 - 2,3)B и достаточно большой силе тока, свидетельствующей о большом расходе электронов.
Поскольку первый и второй электроны атома кислорода удалены от его ядра дальше других электронов, то протон атома водорода, связанный с одним из этих электронов, первым приближается к катоду и получает от него электрон 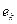 (рис. 54, а). После того, как две молекулы воды получат по электрону
(рис. 54, а). После того, как две молекулы воды получат по электрону 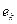 , их поверхностные электроны сразу же соединяются и образуют кластер из двух молекул воды (рис. 54, а, b), соединенных двумя электронами
, их поверхностные электроны сразу же соединяются и образуют кластер из двух молекул воды (рис. 54, а, b), соединенных двумя электронами 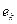 , испущенными катодом. Как видно, в цепочке протонов и электронов, соединяющих две молекулы воды, присутствует молекула ортоводорода (рис. 53, a и 54, а, b). Так как электроны, пришедшие от катода, прошли фазу свободного состояния, то синтез молекулы водорода в этой цепочке сопровождается затратами энергии, величину которой (на
, испущенными катодом. Как видно, в цепочке протонов и электронов, соединяющих две молекулы воды, присутствует молекула ортоводорода (рис. 53, a и 54, а, b). Так как электроны, пришедшие от катода, прошли фазу свободного состояния, то синтез молекулы водорода в этой цепочке сопровождается затратами энергии, величину которой (на 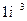 ) мы уже рассчитали (66).
) мы уже рассчитали (66).
Энергия синтеза одного моля молекул водорода равна 436кДж. Переведем её в электрон-вольты в расчете на одну молекулу [32].
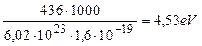 . (67)
. (67)
Величина этой энергии показана справа от молекулы водорода, расположенной в кластерной цепочке (рис. 54), а слева показаны энергии 1,48eV связи атомов водорода с атомами кислорода в молекулах воды. Энергия 4,53eV синтеза молекулы водорода перераспределяет энергии связи в кластерной цепочке таким образом, что энергии 1,48eV связи атомов водорода с атомами кислорода в молекулах воды становятся равными нулю и молекула ортоводорода выделяется из кластерной цепочки (рис. 54, с).
Таким образом, разность между энергией 4,53eV синтеза молекулы водорода и суммарной энергией связи (1,48+1,48) = 2,96 eV оказывается равной (4,53 – 2,96)=1,57eV. Эта энергия расходуется на нагревание электролитического раствора. Поэтому при выделении 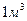 водорода выделится не 44,64х436=19463 кДж, предсказываемых старой теорией электролиза, а следующее количество тепловой энергии
водорода выделится не 44,64х436=19463 кДж, предсказываемых старой теорией электролиза, а следующее количество тепловой энергии
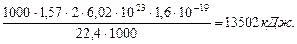 (68)
(68)
При этом у катода идёт химическая реакция
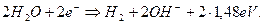 (69)
(69)
Вполне естественно, что количество тепловой энергии 13502кДж является частью общей энергии 4х3600 = 14400 кДж, расходуемой на получение одного кубического метра водорода [32]. Показатель тепловой эффективности этого процесса окажется таким
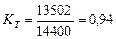 (70)
(70)
Важно иметь в виду, что энергию синтеза молекул кислорода мы не учли. Если же учитывать энергию синтеза молекул кислорода, то надо знать сколько кислорода выделятся при получении 1000 литров водорода. Известно, что из одного литра воды можно получить 1234,44 литра водорода и 604,69 литра кислорода. Тогда при выделении 1000 литров водорода выделится 60469/1234,4=489,86 литра кислорода. Учитывая, что энергия, выделяющаяся при синтезе одной молекулы кислорода, равна 4,95 eV (5,13 Кдж/моль), найдем количество энергии, которая выделится при синтезе 489,86 литров кислорода.
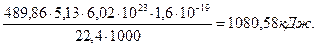 (71)
(71)
Тогда общий показатель тепловой эффективности будет равен
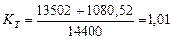 (72)
(72)
Таким образом, показатель общей тепловой эффективности (72) существующего низковольтного процесса электролиза воды близок к единице.
Если учесть, что энергосодержание одного грамма водорода равно 142 кДж, а кубический метр этого газа весит 90 гр., то показатель общей энергетической эффективности будет таким
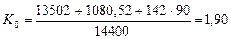 (73)
(73)
Рассмотрим теперь реакции, протекающие у анода (рис. 55). Известно, что ион гидроксила (рис. 55), имея отрицательный заряд 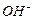 , движется к аноду (рис. 55, а). Два иона гидроксила, отдавая по одному электрону аноду и, соединяясь, друг с другом, образуют перекись водорода
, движется к аноду (рис. 55, а). Два иона гидроксила, отдавая по одному электрону аноду и, соединяясь, друг с другом, образуют перекись водорода 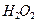 (рис. 55, b).
(рис. 55, b).
Известно также, что процесс образования перекиси водорода эндотермический, а молекулы кислорода - экзотермический. При получении одного кубического метра водорода процесс образования перекиси водорода поглощает 22,32х109,00=2432,88 кДж. В силу этого даже при плазмоэлектролитическом процессе температура раствора в зоне анода остаётся низкой.
Если бы существовал процесс синтеза молекул кислорода, то при получении одного кубического метра водорода в зоне анода выделилось бы 22,32х495,00=11048,40 кДж. Вычитая из этой величины энергию, поглощенную при синтезе перекиси водорода, получим 11048,40-2432,88=8615,52 кДж. Складывая эту энергию с энергией синтеза молекул водорода 19463,00 кДж, получим 28078,52 кДж. В этом случае общий показатель тепловой энергетической эффективности 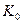 должен быть таким
должен быть таким  =28078,52/14400=1,95. Поскольку в реальности этой энергии нет, то этот факт подтверждает гипотезу об отсутствии процесса синтеза молекул водорода в зоне катода и молекул кислорода в зоне анода при низковольтном электролизе. Молекула водорода (рис. 55, c) и молекула кислорода (рис. 55, c) формируются в кластерных цепочках до выделения в свободное состояние, поэтому и не генерируется энергия их синтеза.
=28078,52/14400=1,95. Поскольку в реальности этой энергии нет, то этот факт подтверждает гипотезу об отсутствии процесса синтеза молекул водорода в зоне катода и молекул кислорода в зоне анода при низковольтном электролизе. Молекула водорода (рис. 55, c) и молекула кислорода (рис. 55, c) формируются в кластерных цепочках до выделения в свободное состояние, поэтому и не генерируется энергия их синтеза.
Рис. 55. Схемы: а) передача электронов  ионами
ионами 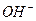 аноду А;
аноду А;
b) образование перекиси водорода 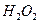 ;
;
с) образование молекулы кислорода 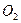 и двух молекул воды d) и e)
и двух молекул воды d) и e)
После передачи двумя ионами гидроксила двух электронов аноду (рис. 55, а) образуется молекула перекиси водорода 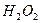 (рис. 55, b), которая, распадаясь, образует молекулу кислорода (рис. 55, с) и два атома водорода. Последние, соединяясь с ионами гидроксила, образуют две молекулы воды (рис. 55, d, e). С учетом этого химическая реакция в зоне анода запишется так
(рис. 55, b), которая, распадаясь, образует молекулу кислорода (рис. 55, с) и два атома водорода. Последние, соединяясь с ионами гидроксила, образуют две молекулы воды (рис. 55, d, e). С учетом этого химическая реакция в зоне анода запишется так
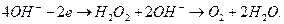 (74)
(74)
Итак, новая теория низковольтного электролиза воды устраняет противоречия старой теории и точнее отражает реальность.
Тут уместно привести точку зрения одного из наших читателей по поводу новой теории электролиза воды: «Филипп Михайлович, большое спасибо за статью "электролиз воды", из которой я узнал о воде больше, чем за всю свою долгую жизнь!!! Все очень четко, сжато, но понятно любому "чайнику", настоящий экстракт знаний! Еще раз - большое спасибо!!! С уважением, А.»
Теперь начнём искать пути реализации экономии электрической энергии, следующие из новой теории процесса электролиза воды. Для этого проанализируем результаты питания лабораторного электролизёра с помощью электронного генератора импульсов напряжения.
На рис. 56 показана осциллограмма напряжения при частоте импульсов около 200Гц. Масштаб записи один к одному. Импульсы не видны, так как их амплитуда ничтожно мала. Измерения показывают, что на осциллограмме зафиксировано напряжение около 13,5 Вольт. Вольтметр показывал в это время 11,4 Вольта.
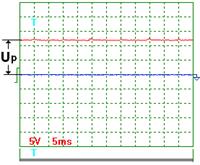 Рис. 56. Напряжение Рис. 56. Напряжение
| 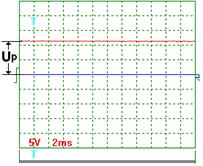 Рис. 57. Напряжение
Рис. 57. Напряжение
| 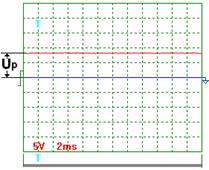 Рис. 58. Напряжение
Рис. 58. Напряжение
|
На рис. 56 показана осциллограмма напряжения на входе в электролизёр через 1 секунду после отключения его от сети. Как видно, электролизер имеет постоянную составляющую 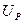 электрического потенциала. Через 3 секунды после отключения электролизёра от сети (рис. 58) потенциал на входе в электролизёр уменьшается с 11,4 В до 8 В, примерно. Осциллограммы на рис. 57 и 58 показывают, что после отключения электролизёра от сети идет процесс его разрядки. Это указывает на то, что электролизёр обладает свойствами конденсатора.
электрического потенциала. Через 3 секунды после отключения электролизёра от сети (рис. 58) потенциал на входе в электролизёр уменьшается с 11,4 В до 8 В, примерно. Осциллограммы на рис. 57 и 58 показывают, что после отключения электролизёра от сети идет процесс его разрядки. Это указывает на то, что электролизёр обладает свойствами конденсатора.
На осциллограмме (рис. 56) импульсы напряжения не видны, так как их амплитуда ничтожно мала. Если увеличить масштаб (записать с открытым входом), то импульсы напряжения выглядят так (рис. 59 и 60).
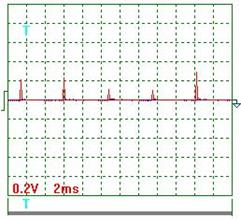 Рис. 59. Напряжение
Рис. 59. Напряжение
|  Рис. 60. Напряжение
Рис. 60. Напряжение
|
Ниже представлены результаты обработки осциллограмм напряжения (рис. 59 и 60). Учитывая масштабный коэффициент, равный 10, найдём среднее значение амплитуды импульсов напряжения
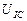 =[(0,20+0,24+0,12+0,10+0,30+0,18+0,16+0,12+0,30+ +0,24+0,30)/11] x10=2,05 В.
=[(0,20+0,24+0,12+0,10+0,30+0,18+0,16+0,12+0,30+ +0,24+0,30)/11] x10=2,05 В.
Период импульсов Т=(24х2)/10=4,8 мс.
Длительность импульсов  =(2х1,45)/10=0,29мс.
=(2х1,45)/10=0,29мс.
Частота импульсов 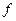 =(1/0,001x4,8)=208,3 Гц.
=(1/0,001x4,8)=208,3 Гц.
Скважность импульсов 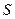 =4,8/0,29=16,55.
=4,8/0,29=16,55.
Коэффициент заполнения 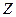 =0,5/16,55=0,0302
=0,5/16,55=0,0302
Таким образом, есть основания полагать, что электролизёр обладает свойствами конденсатора и источника электричества одновременно. Зарядившись в начале, он постепенно разряжается под действием электролитических процессов, протекающих в нём. Количество генерируемой им электрической энергии оказывается недостаточным, чтобы поддерживать процесс электролиза, и он постепенно разряжается. Если его подзаряжать импульсами напряжения, компенсирующими расход энергии, то заряд электролизёра, как конденсатора, будет оставаться постоянным, а процесс электролиза - стабильным.
Величина среднего напряжения, необходимого для компенсации разрядки электролизёра, зафиксирована на осциллограммах рис. 63 и 65. Она равна 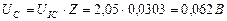 . Вольтметр в это время показывал полное напряжение на клеммах электролизёра, равное 11,4 В.
. Вольтметр в это время показывал полное напряжение на клеммах электролизёра, равное 11,4 В.
На рис. 61 и 62 показаны осциллограммы тока, когда источник питания электролизёра генерировал импульсы с частотой около 200Гц. Результаты обработки этих осциллограмм следующие.
Учитывая масштабный коэффициент, равный 10, и сопротивление резистора 0,10 Ом, найдём среднее значение амплитуды импульсов тока.
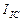 ={[(9,0+7,0+2,0+11,5+6,0+8,5+3,5+9,0+2,5+6,5)/10]x10}/0,10=0,66 А. Средний ток в цепи питания электролизёра
={[(9,0+7,0+2,0+11,5+6,0+8,5+3,5+9,0+2,5+6,5)/10]x10}/0,10=0,66 А. Средний ток в цепи питания электролизёра 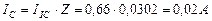 . Эту же величину (0,02А) показывал и амперметр.
. Эту же величину (0,02А) показывал и амперметр.
Таким образом, получается две величины мощности на клеммах электролизёра. Первая, которая до сих пор учитывалась всеми, равна произведению напряжения на клеммах электролизёра (11,40 В) на среднюю величину тока (0,02А), то есть 11,40х0,02=0,23 Ватта.
 Рис. 61. Ток
Рис. 61. Ток
|  Рис. 62. Ток
Рис. 62. Ток
|
Сразу возникает вопрос: какое отношение имеет напряжение на клеммах электролизёра (11,40 В) к расходу энергии на процесс электролиза воды? Ведь оно принадлежит электролизёру, но не источнику питания. Электронный генератор импульсов подавал электролизёру импульсы напряжения (рис. 59, 60), амплитуда которых близка к величине напряжения на клеммах электролизёра. Поэтому для расчёта мощности, расходуемой на питание электролизёра, надо брать среднюю величину импульсов напряжения, также учитывающую их скважность 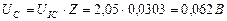 и среднюю величину тока, равную
и среднюю величину тока, равную 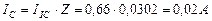 . Тогда реальный расход мощности на подзарядку электролизёра будет равен
. Тогда реальный расход мощности на подзарядку электролизёра будет равен 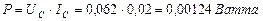 , а не 0,23 Ватта, как считалось до сих пор. Сразу возникает вопрос: как доказать связь с реальностью описанных противоречий? Чтобы найти ответ на этот вопрос, проанализируем процесс питания электролизёра детальнее.
, а не 0,23 Ватта, как считалось до сих пор. Сразу возникает вопрос: как доказать связь с реальностью описанных противоречий? Чтобы найти ответ на этот вопрос, проанализируем процесс питания электролизёра детальнее.
Дата добавления: 2015-04-15; просмотров: 2210;
