Экспериментальная проверка гипотезы низкоамперного электролиза воды
Известно, что при фотосинтезе поглощается углекислый газ 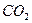 . Считается, что углерод
. Считается, что углерод 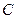 молекулы
молекулы 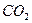 идет на построение клеток растений, а кислород
идет на построение клеток растений, а кислород 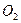 выделяется [1]. Теперь у нас есть основания усомниться в этом и предположить, что молекула
выделяется [1]. Теперь у нас есть основания усомниться в этом и предположить, что молекула 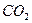 целиком используется на построение клеток растений. Кислород же выделяют молекулы воды и он уходит в атмосферу, а атомы водорода молекул воды используются в качестве соединительных звеньев молекул, из которых строятся клетки растений [2].
целиком используется на построение клеток растений. Кислород же выделяют молекулы воды и он уходит в атмосферу, а атомы водорода молекул воды используются в качестве соединительных звеньев молекул, из которых строятся клетки растений [2].
Возникает вопрос: а нельзя ли смоделировать электролитический процесс разложения воды на водород и кислород, который идет при фотосинтезе? Анализ структуры молекулы воды (рис. 71), выявленной нами, показывает возможность электролиза воды при минимальном токе. На рис. 71 представлена схема молекулы воды с энергиями связи между атомами водорода и кислорода в условиях, когда молекула воды находится в нейтральной среде, без ионов щелочи или кислоты, а также без электрического потенциала, который бы действовал на такие ионы [2].
Протоны атомов водорода в молекулах воды могут соединяться между собой и образовывать кластеры. В результате в цепи кластера образуется молекула ортоводорода (рис. 70, b и 71, а, b, c) [2].
Поиск условий моделирования процесса разложения воды на водород и кислород, который идет при фотосинтезе, привел нас к простой конструкции ячейки, в которой имитированы годовые кольца стволов деревьев в виде зазоров между коническими электродами (рис. 72).
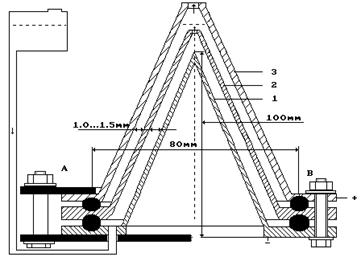
Рис. 72. Низкоамперный электролизер (Пат. № 2227817)
Оказалось, что процесс электролиза может протекать при напряжении 1,5-2,0 В между анодом и катодом и средней силе тока 0,02 А. Поэтому этот процесс назван низкоамперным.
Прежде всего,отметим, что материал анода и катода один – сталь, что исключает возможность формирования гальванического элемента. Тем не менее, на электродах ячейки появляется разность потенциалов около 0,1В при полном отсутствии электролитического раствора в ней. После заливки раствора разность потенциалов увеличивается. При этом положительный знак заряда всегда появляется на верхнем электроде, а отрицательный – на нижнем. Если источник постоянного тока генерирует импульсы, то выход газов увеличивается [2].
Поскольку лабораторная модель ячейки низкоамперного электролизёра генерирует небольшое количество газов, то самым надёжным методом определения их количества является метод определения изменения массы раствора за время опыта и последующего расчета выделившегося водорода и кислорода.
Для дальнейших расчётов необходимо иметь информацию о плотности водорода при различной температуре. Она представлена в табл. 14 [49].
Таблица 14. Плотность водорода при разной температуре
| Температура, град. Цельсия | Плотность, гр./литр |
| 0,0 | 0,0896 |
| 20,0 | 0,0846 |
| 25,0 | 0,0814 |
| 100,0 | 0,0661 |
| 500,0 | 0,0317 |
Примем плотность, соответствующую 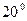 С и равную 0,0846 гр. /л и повторим ещё раз расчёт содержания водорода и кислорода в одном литре воды.
С и равную 0,0846 гр. /л и повторим ещё раз расчёт содержания водорода и кислорода в одном литре воды.
Известно, что грамм-атом численно равен атомной массе вещества, а грамм-молекула – молекулярной массе вещества. Например, грамм-молекула водорода в молекуле воды равна двум граммам, а грамм-атом атома кислорода – 16 граммам. Грамм-молекула воды равна 18 граммам. Так как масса водорода в молекуле воды составляет 2х100/18=11,11%, а масса кислорода – 16х100/18=88,89%, то это же соотношение водорода и кислорода содержится в одном литре воды. Это означает, что в 1000 граммах воды содержится 111,11 грамм водорода и 888,89 грамм кислорода.
Один литр водорода весит 0,0846 гр., а один литр кислорода -1,47 гр. Это означает, что из одного литра воды можно получить 111,11/0,0846=1313,36 литра водорода и 888,89/1,47=604,69 литра кислорода. Из этого следует, что один грамм воды содержит 1,31 литра водорода [44].
Затраты электроэнергии на получение 1000 литров водорода сейчас составляют 4 кВтч, а на один литр – 4 Втч. Поскольку из одного грамма воды можно получить 1,31 литра водорода, то на получение водорода из одного грамма воды сейчас расходуется 1,31х4=5,25 Втч.
Дата добавления: 2015-04-15; просмотров: 2026;
