Низкоамперный электролиз воды
Низковольтный процесс электролиза воды известен со времен Фарадея. Он широко используется в современной промышленности. Рабочим напряжением между анодом и катодом электролизера является напряжение 1,6-2,3 Вольта, а сила тока достигает десятков и сотен ампер. В соответствии с законом Фарадея, затраты энергии на получение одного кубического метра водорода в этом случае составляют около 4 кВтч/ 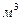 [40]. Минимальное напряжение, при котором начинается процесс электролиза воды, равно 1,23 В [49].
[40]. Минимальное напряжение, при котором начинается процесс электролиза воды, равно 1,23 В [49].
Возникает вопрос: как же идёт электролиз воды при фотосинтезе, когда явно отсутствует источник электроэнергии? Есть основания полагать, что при фотосинтезе молекула водорода выделяется из кластера воды (рис. 70, а и b) в синтезированном состоянии без использования электронов от постороннего источника электроэнергии.
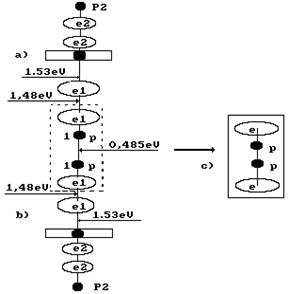
Рис. 70. Схема формирования второй структуры молекулы ортоводорода в структуре кластера из двух молекул воды (0,485 eV – энергия разрыва кластера воды при её испарении)
Функцию первичного источника энергии при фотосинтезе выполняют фотоны, поглощаемые валентными электронами и ослабляющими связи между электронами молекулы ортоводорода и электронами гидроксилов 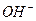 , которые формируются в кластерах воды (рис. 70). В результате молекула ортоводорода выделяется из такого кластера в синтезированном состоянии (рис. 70, с).
, которые формируются в кластерах воды (рис. 70). В результате молекула ортоводорода выделяется из такого кластера в синтезированном состоянии (рис. 70, с).
После выделения молекулы ортоводорода из кластера воды электроны молекул ортоводорода вступают в связь с валентными электронами других атомов и образуются молекулы других химических соединений. Например, молекулы бензола (рис. 71).
Рис. 71. Структура молекулы бензола
В результате молекула водорода разделяется на атомы водорода в условиях отсутствия фазы свободного состояния атомов водорода, которые существуют в плазменном состоянии при температуре до 10000С.
В описанном случае процесс выделения молекулы водорода из кластеров молекул воды идёт без электронов, получаемых из катода. Именно этот процесс электролиза идёт при фотосинтезе и мы попытаемся смоделировать его в техническом устройстве. А сейчас рассмотрим детали процесса выделения молекул водорода из кластера, состоящего из молекулы воды 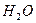 и иона
и иона 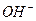 в электрическом поле электролизёра (рис. 72).
в электрическом поле электролизёра (рис. 72).
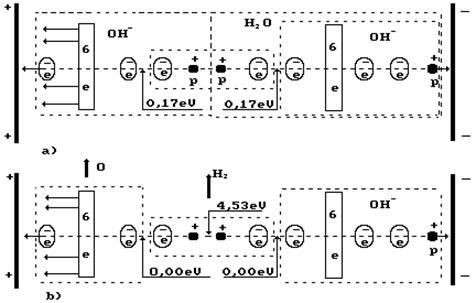
Рис. 72. Схема процесса низкоамперного электролиза
На рис. 72 показан анод слева, а катод справа. Протон Р атома водорода в молекуле воды ориентирован к катоду, а другой протон этой молекулы соединяется с протоном иона 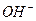 (слева). В результате образуется кластерная цепочка, с правой стороны которой расположена молекула воды
(слева). В результате образуется кластерная цепочка, с правой стороны которой расположена молекула воды 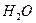 (рис. 50), слева - ион
(рис. 50), слева - ион 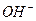 (рис. 52, а), а в центре - молекула ортоводорода
(рис. 52, а), а в центре - молекула ортоводорода 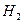 (рис. 53, а, b).
(рис. 53, а, b).
Обратим внимание на то, что осевой электрон атома кислорода и шесть кольцевых электронов иона 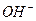 притягиваются к аноду одновременно (рис. 72, а слева). Электростатические силы, притягивающие шесть кольцевых электронов к аноду, деформируют электростатическое поле так, что осевой электрон приближается к ядру атома кислорода, а шесть кольцевых электронов удаляются от ядра атома. В этом случае энергии связи между протонами и электронами в сформировавшейся таким образом молекуле водорода распределяются так, что энергия связи между атомами водорода в его молекуле увеличивается до 4,53 eV, а между электронами атомов кислорода в ионах
притягиваются к аноду одновременно (рис. 72, а слева). Электростатические силы, притягивающие шесть кольцевых электронов к аноду, деформируют электростатическое поле так, что осевой электрон приближается к ядру атома кислорода, а шесть кольцевых электронов удаляются от ядра атома. В этом случае энергии связи между протонами и электронами в сформировавшейся таким образом молекуле водорода распределяются так, что энергия связи между атомами водорода в его молекуле увеличивается до 4,53 eV, а между электронами атомов кислорода в ионах 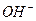 и электронами атомов водорода становятся равными нулю и молекула водорода выделяется из кластерной цепочки. Два атома кислорода образуют его молекулу, и она также выделяется.
и электронами атомов водорода становятся равными нулю и молекула водорода выделяется из кластерной цепочки. Два атома кислорода образуют его молекулу, и она также выделяется.
Таким образом, в электролитическом растворе под действием электростатического поля формируются сложные кластерные цепочки со строгой ориентацией между анодом и катодом [41]. Под действием электрического поля кластерная цепочка удлиняется, одновременно изменяются и энергии связи между элементами такой цепочки. Если мы возьмём за основу результаты эксперимента, приведенные на рис. 72, а, то минимальная энергия (≈4 Вт), при которой идет процесс электролиза, приведенная к энергии связи (0,17 eV) между электронами иона 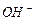 в цепочке (рис. 72, а) и молекулы воды, оказывается порядка 0,17 eV. Две таких связи дают энергию 0,34 eV, что меньше энергии 0,485 eV , при которой кластер из двух молекул разрывается при испарении молекул воды. Кроме этого, формирование молекулы ортоводорода увеличивает энергию связи между атомами водорода с 0,485 eV до 4,53 eV. Энергии связи 0,17 eV (рис. 72, а) уменьшаются до нуля (рис. 72, b) и сформировавшаяся молекула ортоводорода оказывается свободной.
в цепочке (рис. 72, а) и молекулы воды, оказывается порядка 0,17 eV. Две таких связи дают энергию 0,34 eV, что меньше энергии 0,485 eV , при которой кластер из двух молекул разрывается при испарении молекул воды. Кроме этого, формирование молекулы ортоводорода увеличивает энергию связи между атомами водорода с 0,485 eV до 4,53 eV. Энергии связи 0,17 eV (рис. 72, а) уменьшаются до нуля (рис. 72, b) и сформировавшаяся молекула ортоводорода оказывается свободной.
Конечно, это упрощенная схема. При более сложном процессе возможно формирование молекул перекиси водорода перед образованием молекулы кислорода. Именно к этому приводит малейшее нарушение оптимального сочетания параметров процесса электролиза.
Рассмотрим теперь реакции, протекающие у анода. Известно, что ион гидроксила (рис. 72, а), имея отрицательный заряд 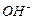 , движется к аноду (рис. 72, а). Два иона гидроксила, отдавая по одному электрону аноду и, соединяясь, друг с другом, образуют перекись водорода
, движется к аноду (рис. 72, а). Два иона гидроксила, отдавая по одному электрону аноду и, соединяясь, друг с другом, образуют перекись водорода 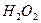 (рис. 72, b).
(рис. 72, b).
Известно, что процесс образования перекиси водорода эндотермический, а молекулы кислорода - экзотермический. При получении одного кубического метра водорода процесс образования перекиси водорода поглощает 22,32х109,00=2432,88 кДж. В силу этого даже при плазмоэлектролитическом процессе температура раствора в зоне анода остаётся низкой.
Если бы существовал процесс синтеза молекул кислорода, то при получении одного кубического метра водорода в зоне анода выделилось бы 22,32х495,00=11048,40 кДж. Вычитая из этой величины энергию, поглощенную при синтезе перекиси водорода, получим 11048,40-2432,88=8615,52 кДж. Складывая эту энергию с энергией синтеза молекул водорода 19463,00 кДж, получим 28078,52 кДж. В этом случае общий показатель тепловой энергетической эффективности 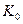 должен быть таким
должен быть таким 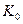 =28078,52/14400=1,95. Поскольку в реальности этой энергии нет, то этот факт подтверждает гипотезу об отсутствии процесса синтеза молекул водорода в зоне катода и молекул кислорода в зоне анода при низковольтном электролизе. Молекула водорода (рис. 72, b) и атом кислорода (рис. 72, b) формируются в кластерных цепочках до выделения их в свободное состояние, поэтому и не генерируется энергия их синтеза.
=28078,52/14400=1,95. Поскольку в реальности этой энергии нет, то этот факт подтверждает гипотезу об отсутствии процесса синтеза молекул водорода в зоне катода и молекул кислорода в зоне анода при низковольтном электролизе. Молекула водорода (рис. 72, b) и атом кислорода (рис. 72, b) формируются в кластерных цепочках до выделения их в свободное состояние, поэтому и не генерируется энергия их синтеза.
После передачи двумя ионами гидроксила двух электронов аноду (рис. 72, а) образуется молекула перекиси водорода (рис. 72, b), которая, распадаясь, образует молекулу кислорода (рис. 72, с) и два атома водорода; последние, соединяясь с ионами гидроксила, образуют две молекулы воды (рис. 72, d,e). С учетом этого химическая реакция в зоне анода запишется так
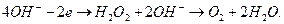 (97)
(97)
А теперь опишем результаты экспериментов, показывающих связь, новой теории электролиза воды с реальностью.
Дата добавления: 2015-04-15; просмотров: 3650;
