Координационная теория Вернера
По Вернеру формулу комплексного соединения можно разбить на две части: внутреннюю сферу и внешнюю сферу.
Внутренняя сфера (синонимы: комплексная частица, комплекс) состоит из центрального атома или иона (комплексообразователь) и частиц, окружающих комплексообразователь (лиганды). В формуле вещества комплекс выделяется квадратными скобками. Во внешнюю сферу входят обычные ионы, которые компенсируют общий заряд комплекса. Если комплекс имеет нулевой заряд, то внешняя сфера в соединении отсутствует.
Пример 1. [Zn+2(NH3) 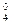 ]+2(OH)
]+2(OH) 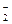
комплекс [Zn(NH3)4]+2
комплексообразователь Zn+2
лиганды NH3
внешняя сфера ионы ОH-.
Пример 2. K 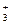 [Fe+3 (CN)
[Fe+3 (CN) 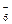 ]-3
]-3
комплекс [Fe(CN)6]-3
комплексообразователь Fe+3
лиганды CN-
внешняя сфера ионы К+.
Пример 3. [Pt+2(NH3) 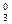 Cl
Cl 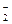 ]0
]0
комплекс [Pt (NH3)2Cl2]
комплесообразователь Pt+2
лиганды NH3 и Cl-
внешняя сфера отсутствует.
Пример 4. [Fe0(CO) 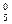 ]
]
комплекс [Fe(CO)5]
комплексообразователь атом Fe
лиганды СО (молекулы)
внешняя сфера отсутствует.
В большинстве комплексных соединений в качестве комплексообразователей выступают ионы или атомы d- и f- металлов. Значительно реже - катионы р - элементов (в основном р - металлов). Для комплексообразователя вводится понятие о координационном числе (КЧ). КЧ равно числу s - связей между комплексообразователем и лигандами в комплексе. В настоящее время обнаружены следующие КЧ = 1, 2, 3, 4, 5, 6, 7, 8, 9 и 12. Чаще всего встречается КЧ= 6, 4 и 2.
Как правило, один и тот же комплексообразователь в своих комплексах может проявлять различные координационные числа. Так, например, ион Со+2 в одних комплексах имеет КЧ=4 [CoCl4]-2, а в других - КЧ=6 [Co(H2O)6]+2 .
КЧ является понятием аналогичным валентности, поэтому раньше для КЧ использовался синоним: “координационная валентность”.
В качестве лигандов в комплексе могут выступать как различные анионы (F-; Cl-; Br-; J-; OH-; CN-; CNS-; NO 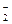 ; SO
; SO 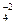 и т.д.), так и некоторые молекулы (NH3; H2O; CO; NO; Cl2 и т.д.). Лиганды характеризуются координационной емкостью (дентатность), равной числу s - связей, которыми данный лиганд соединен с комплексообразователем. Известны лиганды с дентатностью 1(монодентатные), 2 (бидентатные), 3 (тридентатные), 4 (тетрадентатные), 6 (гексадентатные). Лиганды с дентатностью 2, 3, 4 и 6 называются полидентатными. Подавляющее большинство лигандов - монодентатны (образуют одну связь с комплексообразователем): H2O ; NH3 ; OH- ; F- ; Cl- ; Br- ; J- и т.д. Полидентатных лигандов значительно меньше. Например, бидентатными лигандами являются оксалат-анионы С2О
и т.д.), так и некоторые молекулы (NH3; H2O; CO; NO; Cl2 и т.д.). Лиганды характеризуются координационной емкостью (дентатность), равной числу s - связей, которыми данный лиганд соединен с комплексообразователем. Известны лиганды с дентатностью 1(монодентатные), 2 (бидентатные), 3 (тридентатные), 4 (тетрадентатные), 6 (гексадентатные). Лиганды с дентатностью 2, 3, 4 и 6 называются полидентатными. Подавляющее большинство лигандов - монодентатны (образуют одну связь с комплексообразователем): H2O ; NH3 ; OH- ; F- ; Cl- ; Br- ; J- и т.д. Полидентатных лигандов значительно меньше. Например, бидентатными лигандами являются оксалат-анионы С2О 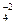 (это кислотный остаток щавелевой кислоты), SO
(это кислотный остаток щавелевой кислоты), SO 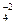 ; CO
; CO 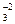 . Причем, ионы SO
. Причем, ионы SO 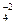 и СО
и СО 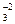 в некоторых комплексах являются монодентатными.
в некоторых комплексах являются монодентатными.
Пример. Ион Со+3 образует комплексы [Co(NH3)4SO4]+ и [Co(NH3)5SO4]+. В этих комплексах КЧ (Со+3)= 6.
Дентатность лиганда NH3 всегда равна 1, поэтому ион SO 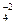 в первом комплексе бидентатен, а во втором - монодентатен.
в первом комплексе бидентатен, а во втором - монодентатен.
Дата добавления: 2015-04-29; просмотров: 1807;
