Боровская теория атома водорода
Рассмотрим электрон, движущийся в электрическом поле ядра атома водорода с зарядом 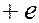 . Масса ядра почти в 2000 раз больше массы электрона, поэтому ядро можно считать неподвижным. Для простоты Бор принял, что электрон вращается вокруг ядра по круговой орбите. Согласно условию квантования (7.42.9), момент импульса электрона равен
. Масса ядра почти в 2000 раз больше массы электрона, поэтому ядро можно считать неподвижным. Для простоты Бор принял, что электрон вращается вокруг ядра по круговой орбите. Согласно условию квантования (7.42.9), момент импульса электрона равен
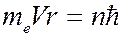 (
( 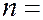 1, 2, 3, ….), (7.42.13)
1, 2, 3, ….), (7.42.13)
где 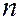 – главное квантовое число. Отсюда скорость электрона:
– главное квантовое число. Отсюда скорость электрона:
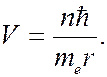 (7.42.14)
(7.42.14)
Кулоновская сила при движении электрона по окружности вызывает центростремительное ускорение. Следовательно:
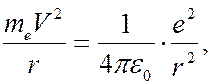 (7.42.15)
(7.42.15)
где 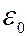 – электрическая постоянная. Подставив (7.42.14) в (7.42.15), получаем, что радиус электронных орбит в атоме водорода может принимать лишь ряд дискретных значений:
– электрическая постоянная. Подставив (7.42.14) в (7.42.15), получаем, что радиус электронных орбит в атоме водорода может принимать лишь ряд дискретных значений:
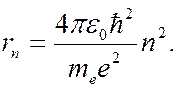 (7.42.16)
(7.42.16)
При 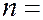 1 получаем радиус первой электронной орбиты атома водорода:
1 получаем радиус первой электронной орбиты атома водорода:
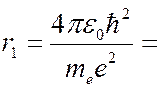 0,529∙10 -10 м, (7.42.17)
0,529∙10 -10 м, (7.42.17)
что соответствует газокинетическим размерам атома водорода. Полная энергия электрона слагается из кинетической энергии и потенциальной энергии взаимодействия с ядром:
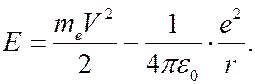 (7.42.18)
(7.42.18)
Из (7.42.15) следует, что
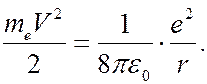 (7.42.19)
(7.42.19)
Подставив (7.42.19) в (7.42.18), получим:
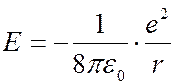 . (7.42.20)
. (7.42.20)
Учитывая значения радиусов электронных орбит, определяемых формулой (7.42.16), получаем дискретные значения энергии электрона в атоме водорода:
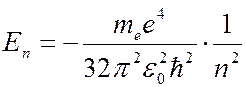 (
( 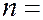 1, 2, 3, …). (7.42.21)
1, 2, 3, …). (7.42.21)
Энергия электрона в атоме водорода может принимать ряд дискретных значений, определяемых формулой (7.42.21), т.е. квантуется. Схема энергетических уровней электрона в атоме водорода изображена на рисунке. При 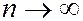 уровни энергии стремятся к своему предельному значению
уровни энергии стремятся к своему предельному значению 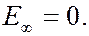 Состояние атома с наименьшей энергией (
Состояние атома с наименьшей энергией ( 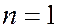 ) называется основным:
) называется основным:
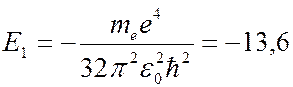 эВ. (7.42.22)
эВ. (7.42.22)
Если атом поглощает энергию извне, энергия электрона увеличивается, и он переходит на орбиту с боьшим радиусом. Если сообщенная электрону энергия достаточно велика, то он может перейти на орбиту с  , т.е. покинуть пределы атома. В результате атом ионизируется. Энергия ионизации
, т.е. покинуть пределы атома. В результате атом ионизируется. Энергия ионизации 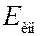 для атома водорода в основном состоянии (
для атома водорода в основном состоянии ( 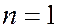 ) равна
) равна
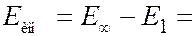
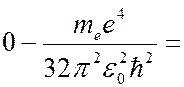
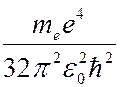 = 13,6 эВ.
= 13,6 эВ.

Уровни энергии стационарных состояний
электрона в атоме водорода
В соответствии правилом частот Бора (7.42.11) атом излучает при переходе электрона с одной стационарной орбиты на другую с меньшей энергией:
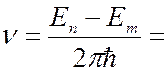
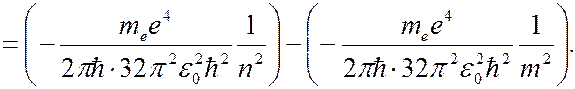
(7.42.23)
Сравнивая (7.42.23) с (7.42.7), для постоянной Ридберга получаем выражение:
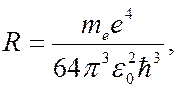 (7.42.24)
(7.42.24)
численное значение которой хорошо совпадает с экспериментальным. Различные серии в спектре атома водорода образуются в результате перехода электрона с внешних орбит на определенную внутреннюю орбиту. Например, серия Бальмера испускается в результате переходов электрона с третьей, четвертой, пятой орбит и т.д. на вторую орбиту. На рисунке показаны переходы электронов, соответствующие сериям Лаймана, Бальмера и Пашена. Спектры не дают картины движения электрона в атоме. Частота излучения не связана с частотой обращения электрона вокруг ядра. Спектры позволяют сделать вывод об изменении энергии при переходе электрона из одного стационарного состояния в другое.
Частоты спектральных линий в спектре атома водорода, вычисленные по теории Бора, хорошо совпали с экспериментом, подтвердив тем самым неприменимость классической физики для описания внутриатомных явлений. Существование дискретных энергетических уровней атома было подтверждено опытами, осуществленными Франком и Герцем.
Однако с самого начала выявились существенные недостатки теории Бора. Она правильно давала значения частот спектральных линий, но не позволяла вычислять их интенсивности и др. характеристики излучения. Попытки рассчитать в рамках теории Бора спектр атома гелия окончились неудачей. Основным недостатком теории Бора была ее непоследовательность и внутренняя противоречивость: она полуклассической, полуквантовой теорией. Она оперировала стационарными электронными орбитами и квантовыми скачками электронов, что противоречило классической механике. Для описания движения электронов по стационарным орбитам теория Бора применяла законы классической механики, хотя считала неприменимой классическую электродинамику. Поэтому теория Бора явилась очень важным переходным этапом от классической механики к последовательной квантовой механике.
Контрольные вопросы для самоподготовки студентов:
1. Обобщенная формула Бальмера.
2. Модель атома Резерфорда. Противоречия ядерной модели атома.
3. Постулаты Бора.
4. Боровская теория атома водорода.
5. В чем заключаются трудности теории Бора?.
Литературные источники:
1. Трофимова, Т.И. Курс физики: учеб. пособие для вузов / Т.И. Трофимова. – М.: ACADEMIA, 2008.
2. Савельев, И.В. Курс общей физики: учеб. пособие для втузов: в 3-х томах / И.В.Савельев. – СПб.: Спец. лит., 2005.
Дата добавления: 2015-05-26; просмотров: 2578;
