Абсорбционные методы очистки от сероводорода, меркаптанов
Очистка от сероводорода. Сероводород содержится как примесь в природном газе и нефтяных, коксохимических газах, выделяется при выпарке целлюлозных щелоков. Технологические и топочные газы, содержащие сероводород, очень коррозионноактивны.
Для очистки газов от сероводорода применяют различные хемосорбционные методы. Характеристика абсорбентов сероводорода и параметры процессов приведены в табл. 1.3.
Вакуум-карбонатные методы. В этих методах сероводород поглощается из газов водным раствором карбоната натрия или калия. Затем раствор регенерируют нагреванием под вакуумом, охлаждают и снова возвращают на абсорбцию. В основе методов лежат реакции:
Me2CO3 + H2S ↔ MeHCO3 + MeHS,
Me2CO3 + H2O + CO2 ↔ 2MeHCO3,
MeHS + CO2 + H2O ↔ MeHCO3 + H2S (1.132)
Вследствие различной растворимости Nа2СO3, NаНСО3, K2CO3 и KHCO3 для абсорбции применяют растворы разной концентрации. Поташ лучше растворим в воде, поэтому применяются более концентрированные его растворы, которые имеют высокую поглотительную способность. Это позволяет уменьшить его расход, а также сократить расход пара на регенерацию поташа и расход энергии на перекачивание раствора.
Недостатком использования растворов поташа является их высокая стоимость. Исходя из этого, чаще используют содовый метод.
Если производится регенерация раствора без рекуперации сероводорода, то раствор нагревают в регенераторе, а из него воздухом отдувают сероводород. При этом некоторое количество сульфида
Таблица 1.3.
Характеристика абсорбентов сероводорода ч параметры процесса
| Абсорбент | Емкость поглотителя, моль/моль | Концентрация поглотителя в растворе | Температура абсорбции, ºС | Степень абсорбции, % | |
| % | г/л | ||||
| Мышьяково-содовый (окситиомышьяково-натриевая соль) | 1/1 | 17,38 | — | 20-45 | 92-98 |
| Мышьяково-поташный | 3/1 | — | 16-18 | 35-50 | 94-99 |
| Этанола мины | 1/2 | — | 10-15 | 20-50 | 96-98 |
| Нормальный метил-2-пирролидон | — | — | — | 26-40 | 96-98 |
| Соловый | — | 15-18 | — | ||
| Поташный | — | 20-25 | — | 40-50 | 90-98 |
| Цианамид кальция | 3/1 | — | 150-200 | 30-45 | 98 -99 |
| Раствор соды и сульфата никеля | — | 15-25 | — | 30-40 | 95-97 |
| Раствор фосфата калия | 1/1 | 40-50 | — | 20-40 | 92-97 |
| Аммиачный раствор | 1/1 | 5-15 | 20-30 | 85-90 |
натрия окисляется до тиосульфата, что приводит к понижению концентрации абсорбирующей жидкости, поэтому периодически ее заменяют свежей. Технологическая схема очистки газа от сероводорода вакуум-карбонатным методом с получением из сероводорода серной кислоты приведена на рис. 1-31, а.
После очистки газа в абсорбере раствор подают в холодильник-конденсатор, где его подогревают за счет тепла конденсации паров, выделяющихся при регенерации поглотительного раствора. Затем раствор проходит теплообменник и подогреватель и поступает в регенератор. Раствор регенерируют кипячением под вакуумом (15,6 кПа). Регенерированный раствор направляют в емкость, а затем через теплообменник и холодильник — на орошение абсорбера. Выделяющиеся при регенерации раствора пары сероводорода и воды отсасывают вакуум-насосом через конденсатор-холодильник, где конденсируется значительная часть паров воды. Далее пары поступают в холодильник, а затем в печь для сжигания сероводорода. Из печи газовая смесь, состоящая из диоксида серы, водяных паров, кислорода и инертных газов, при 900°С поступает в котел-утилизатор, где охлаждается до 440-450°С, а затем направляется на окисление в контактный аппарат. После окисления газы направляют на абсорбцию для получения серной кислоты.
Фосфатный процесс. Для абсорбции сероводорода фосфатным методом применяют растворы, содержащие 40-50% фосфата калия:
K3PO4 + H2S ↔ KHS + K2HPO4 (I.133)
Из раствора сероводород удаляют кипячением при 107-115°С. Коррозии кипятильников при этом не наблюдается. Растворы стабильны, не образуют продуктов, ухудшающих их качество. Достоинством процесса является также селективность раствора к сероводороду в присутствии SO2.
Мышьяково-щелочные методы. В зависимости от абсорбента эти методы подразделяются на мышьяково-содовый и мышьяково-аммиачный. Для приготовления абсорбентов оксид мышьяка Аs2O3 растворяют в растворе Na2СO3 или NH4OH. При растворении в содовом растворе происходит реакция:
2Na2CO3 +А s2O3 + Н2O ↔ 2 Na2HАs2O3 +2СO2 (I.134)
Образование поглотительного раствора происходит в процессе взаимодействия с сероводородом:
2 Na2HАsO3 + 5 H2S ↔ Na4As2S5 + 6H2O (I.135)
Na4As2S5 + O2 ↔ Na4As2S5O2 (I.136)
Полученный раствор оксисульфомышьяково-натриевой соли и является поглотительным раствором для сероводорода. Абсорбция протекает по реакции:
Na4As2S5O2 + H2S = Na4As2S6O + H2O (1.137)
При регенерации полученной соли кислородом воздуха выделяется сера:
2 Na4As2S6O + O2 = 2 Na4As2S5O2 + 2S (I.138)
Серу отделяют от раствора, а регенерированный раствор возвращают на абсорбцию. Побочные реакции, протекающие в процессе:
Na2CO3 + H2O = NaOH + NaHCO3
Na2CO3 + H2S = NaHS + NaHCO3
Na2CO3 + H2S = NaHS + CO2 + H2O
NaOH + H2S = NaHS + H2O (I.139)
Схема процесса (процесс "Тiloks") приведена на рис. 1-31,б.
Очищаемый газ поступает в абсорбер, где происходит его очистка от сероводорода. Далее насыщенный сероводородом раствор перекачивают через теплообменник, где он нагревается до 40°С и затем поступает на регенерацию. В регенератор подают сжатый воздух, который барботирует через раствор. После окисления кислородом воздуха и отделения серы, которая всплывает вместе с пузырьками воздуха в сепараторе, раствор возвращают на абсорбцию. Серу отделяют на вакуум-фильтре.
На интенсивность абсорбции влияет концентрация мышьяка в поглотителе и рН раствора. При увеличении концентрации с 15 до 25 г/л степень абсорбции сероводорода возрастает с 81 до 97%. Оптимальное значение рН должно быть 7,8-7,9.
Недостатком процесса является высокий расход соды (400-500 кг на 1т серы), большое содержание примесей в абсорбенте, что осложняет его регенерацию.
Технологические схемы и аппаратура мышьяково-содового и мыщьяково-аммиачного способов идентичны.
Процесс "Stretford". В этом процессе сероводород абсорбируют щелочным раствором (рН = 8,5-9,5), содержащим кроме карбоната натрия эквимолекулярное количество ванадата натрия-аммония и антрахинон-2,6-2,7-дисулъфоната (АДА). Кроме того, к раствору добавляют натрий-калиевую соль винной кислоты, чтобы ванадат не выпадал в осадок.
Суммарные реакции:
абсорбция
H2S + Na2CO3 = NaHS + NaHCO3 (1.140)
получение серы
2 NaHS + H2S + 4NaVO3 → Na2V4O9 + 4NaOH + 2S (1.141)
рекуперация ванадата при помощи АДА
Na2V4O9 + 2NaOH + H2O + 2АДА → 4NaVO3 + 2АДА(восст.) (1.142)
окисление АДА кислородом воздуха
2АДА (восст.) + O2 → 2АДА + H2O (1.142а)
Достоинством процесса является возможность исключить очень токсичные арсениты.
Железо-содовый метод. В этом процессе для поглощения используют взвесь гидроксидов двух- и трехвалентного железа. Суспензию приготавливают смешением 10%-го раствора Na2CO3 с 18%-м раствором железного купороса:
FeSO4 + Na2CO3 + H2O → Fe(OH)2 + Na2SO4 + CO2 (1.143)
пропуская через раствор воздух, окисляют гидроксид железа:
4 Fe(OH)2 + O2 + 2H2O → 4 Fe(OH)3 (1.144)
Абсорбция сероводорода из газовой фазы протекает по следующим реакциям:
H2S + Na2CO3 → NaHS + NaHCO3 ,
3 NaHS + 2 Fe(OH)3 → Fe2O3 +3NaOH + 3H2O,
3 NaHS + 2 Fe(OH)3 → FeS + S + 3NaOH + 3 H2O (1.145)
Для регенерации раствора через него пропускают воздух, в этом процессе образуется элементная сера:
2 Fe2S3 + 6 H2O + 3 O2 → 4 Fe(OH)3 + 6 S,
4 FeS + 6 H2O + 3 O2 → 4 Fe(OH)3 + 4 S,
NaHCO3 + NaOH → Na2CO3 + H2O,
2 NaHCO3 → Na2CO3 + H2O + CO2. (I.146)
При регенерации до 70% поглощенного Н2S переходит в элементную серу, а остальной (в виде NaHS) окисляется до тиосульфата натрия:
2 NaHS + 2O2 → Na2S2O3 + H2O (1.147)
Метод позволяет достичь степени очистки более 80%.
Щелочно-гидрохиноновый метод. Сущность метода заключается в поглощении сероводорода щелочными растворами гидрохинона. При регенерации растворов выделяются элементная сера и тиосульфат натрия. Гидрохинон является катализатором. Чем выше концентрация хинона в растворе, тем активнее раствор. Метод состоит из следующих стадий:
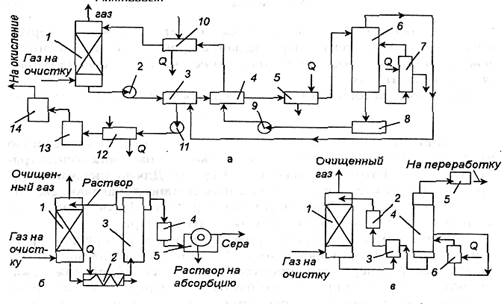
Рис. 1-31. Схемы установок очисти газа от сероводорода: а — вакуум-карбонатным методом: 1 — абсорбер; 2,9 — насосы; 3—холодильник-конденсатор; 4 — теплообменник; 5 — подогреватель; 6 — регенератор; 7 — циркуляционный подогреватель; 8— сборник; 10 —холодильник; 11 —вакуум-насос; 12—-холодильник; 13 — печь; 14 — котел-утилизатор; б — в процессе "Tiloks": 1 — колонна; 2 — теплообменник; 3 — колонна для окисления; 4 — емкость; 5 — фильтр; в — раствором этанол амина: 1 — абсорбер; 2,5 —холодильники; 3,6 — теплообменники; 4 — регенератор
взаимодействие сероводорода с карбонатом натрия (содой):
H2S + Na2CO3 → NaHS + NaHCO3 (1.148)
окисление гидросульфида натрия хиноном (окисленная форма гидрохинона):
NaHS + O= 
 =O + H2O → HO−
=O + H2O → HO− 
 −OH + S↓ + NaOH (I.149)
−OH + S↓ + NaOH (I.149)
регенерация соды:
NaHCO3 + NaOH → Na2CO3 + H2O (1.150)
регенерация хинона:
HO− 
 −OH + 0.5 O2 → O=
−OH + 0.5 O2 → O= 
 =O + H2O (I.151)
=O + H2O (I.151)
Последняя стадия осуществляется за счет кислорода, содержащегося в газе, и протекает параллельно с процессами поглощения и окисления сероводорода. Более полную регенерацию хинона проводят в регенераторах.
В процессе абсорбции протекает следующая побочная реакция:
2 NaHS + 2O2 → Na2S2O3 + H2O (1.152)
Накопление в растворе Na2S2O3 и NaHCO3 приводит к снижению его поглотительной способности вследствие уменьшения концентрации карбоната натрия и снижения рН среды, Для поддержания активности поглотительного раствора непрерывно добавляют свежие растворы соды и гидрохинона. Для поддержания рН раствора в пределах 9-9.5 добавляют 42%-й раствор едкого натра.
Абсорбцию сероводорода проводят в полом абсорбере с форсунками при плотности орошения 4,35 м3/ч на 1 м3 орошаемого объема. Раствор регенерируют, пропуская через него (барботаж) сжатый воздух. При этом происходит окисление гидрохинона до хинона и флотация выделившейся серы, которую в виде пены собирают на поверхности раствора. Одновременно здесь же происходит окисление части гидросульфида до тиосульфата. Серная пена собирается в пеносборнике, а затем поступает на вакуум-фильтр, где происходит ее отделение. Полученную серу плавят в автоклаве.
Метод позволяет очищать газ от начального содержания сероводорода в газе 0,185 г/м3 до 0,02 г/м3. Степень очистки газа зависит от концентрации в нем сероводорода, скорости движения газа в абсорбере и интенсивности орошения, концентрации активных компонентов в растворе и его рН, температуры процесса, от равномерности распределения раствора в абсорбере.
Абсорбция этаноламинами. В этих методах сероводород и диоксид углерода поглощаются растворами моноэтаноламина или триэтаноламина. Преимущественно используют 15-20%-й водный раствор моноэтаноламина, поскольку он обладает большей поглотительной способностью на единицу массы растворителя, большей реакционной способностью и легко регенерируется.
Технологическая схема очистки газов от сероводорода растворами этаноламинов представлена на рис. 1-31, в. В процессе поглощения протекают реакции:
OH−CH2−CH2−NH3
2(OH− CH2−CH2−NH2) + H2S ↔ S (I.153)
OH−CH2−CH2−NH3
OH−CH2−CH2−NH3
S + H2S ↔ 2(OH− CH2−CH2−NH3−HS) (I.154)
OH−CH2−CH2−NH3
При 25-40°С направление реакции поглощения — слева направо, с повышением температуры до 105°С и выше направление — справа налево с удалением из раствора сероводорода и диоксида углерода. Это связано с тем, что раствор постепенно теряет свои щелочные свойства, а образовавшиеся сульфиды и карбонаты аминов диссоциируют с выделением сероводорода и диоксида углерода в газовую фазу.
Очистка от сероуглерода и меркаптанов. В газах могут содержаться следующие органические соединения серы: сероуглерод СS2 и серооксид углерода СОS, меркаптаны RSН.
Сероуглерод малоактивен при обычной температуре, поэтому хемосорбционные методы его извлечения из воздуха малоэффективны. Газы, содержащие СS2 и СОS, подвергают конверсии до Н2S с применением железохромового катализатора при 400-500°С или медного при 600 °С. Затем образующийся Н2S поглощают щелочными растворами. Однако для очистки газов, содержащих СS2 и СОS, наиболее экономичны абсорбционные методы.
Низшие меркаптаны хорошо растворяются в щелочах, но с увеличением молекулярной массы их растворимость уменьшается. Процесс протекает по реакции:
NaОН + RSH ↔ NаRS+Н2O. (1.155)
При длительном контакте со щелочью (в присутствии кислорода и диоксида углерода) меркаптаны окисляются до дисульфидов и полисульфидов, плохо растворимых в щелочи:
4RSH + O2 → 2R−S−S−R + 2H2O (1.156)
Абсорбцию проводят при скорости газа 0,3-0,4 м/с под давлением 1 МПа. При большом содержании в газах СO2 в абсорбере происходит образование соды, которую необходимо непрерывно удалять. Целесообразно проводить двухступенчатую очистку: на I ступени сорбировать СO2 моноэтаноламином, на II — производить щелочное поглощение меркаптана.
Для регенерации сорбента проводят десорбцию этилмеркаптана
отдувкой паром или нагретым воздухом с подогревом раствора до
70-90°С. Регенерацию проводят в насадочных или тарельчатых колоннах.
Дата добавления: 2015-06-10; просмотров: 7405;
