Описание гидролиза как обратимого процесса
Гидролиз по катиону и гидролиз по аниону являются обратимыми процессами. Если при совместном гидролизе не происходит выделение газа или образование осадка, то это то же обратимый процесс.
Если гидролиз является обратимым процессом, то для него можно ввести понятие о константе равновесия:
CO 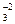 + H2O
+ H2O  HCO
HCO 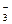 + OH- ,
+ OH- ,
Kp = 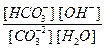 .
.
В разбавленных растворах солей концентрацию молекул воды можно считать практически постоянной (H2O) » 55 моль / л и получить другую константу равновесия (константу гидролиза):
Kг I = Kp [H2O] = 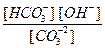 ,
,
где Кг I - константа гидролиза карбонат-аниона (по первой ступени).
Величину константы гидролиза можно рассчитать, исходя из константы воды (К = 10-14) и константы диссоциации слабого электролита по одной из ступеней:
Kг I =  ,
,
где К = [H+] × [OH-] = 10-14; Kд II =  -константа диссоциации угольной кислоты по второй ступени.
-константа диссоциации угольной кислоты по второй ступени.
Глубину протекания гидролиза описывает степень гидролиза (h) - это отношение числа частиц, подвергшихся гидролизу к общему количеству гидролизующихся частиц в растворе.
Степень гидролиза (h) зависит от концентрации гидролизующихся частиц по уравнению:
Kг 1 = 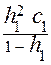 ,
,
где Кг1 - константа гидролиза по первой ступени;
h1 - cтепень гидролиза по первой ступени;
с1 - концентрация частиц, гидролизующихся по первой ступени (в нашем
примере с1 = [CO 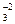 ]).
]).
Так как степень гидролиза даже по первой ступени обычно заметно меньше, чем 0,1 , то данное выражение можно упростить:
h1 = 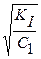 .
.
Аналогичные соотношения имеют место и для второй ступени гидролиза:
HCO 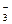 + H2O
+ H2O  H2CO3 + OH- ,
H2CO3 + OH- ,
Kг II = 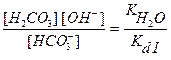 ,
,
где Кd I - константа диссоциации угольной кислоты по первой ступени.
h2 = 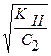 , где c2 = [HCO
, где c2 = [HCO 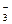 ]
]
Дата добавления: 2015-04-29; просмотров: 1260;
