Ионные уравнения реакций
В качестве примера рассмотрим взаимодействие соляной кислоты и гидроксида натрия в водном растворе:
HCl + NaOH = NaCl + H2O.
Это уравнение написано в молекулярном виде. Молекулярное уравнение данного процесса не отражает реальных явлений, имеющих место при протекании такого взаимодействия, так как в приведенном примере все вещества, кроме воды, являются сильными электролитами и в растворе присутствуют не в виде молекул, а только в виде ионов:
HCl = H+ + Cl-,
NaOH = Na+ + OH-,
NaCl = Na+ + Cl-.
Поэтому уравнение нейтрализации логичнее написать в ионном виде. При переходе от молекулярного к ионному (точнее: полному ионному) уравнению на ионы разбиваются только формулы сильных электролитов, хорошо растворимых в воде:
H+ + Cl- + Na+ + OH- = Na+ + Cl- + H2O.
Полученное выражение можно сократить и получить сокращенное ионное уравнение:
H+ + OH- = H2O.
Сокращенное ионное уравнение показывает, что данное взаимодействие сводится к реакции между ионами водорода и гидроксид-анионами с образованием молекул слабого электролита (воды).
Аналогичным образом следует рассматривать и другие процессы, протекающие в растворах с участием электролитов.
Пример 1. CO2 + 2 NaOH = Na2CO3 + H2O
CO2 + 2Na+ + 2OH- = 2Na+ + CO 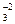 + 2H2O
+ 2H2O
CO2 + 2OH- = CO 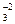 + 2H2O
+ 2H2O
Пример 2. 2AgNO3 + Na2S = Ag2S¯ + 2NaNO3
2Ag+ + 2NO 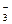 + 2Na+ + S-2 = Ag2S¯ + 2Na+ + 2NO
+ 2Na+ + S-2 = Ag2S¯ + 2Na+ + 2NO 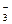
Тема 7. Равновесия в растворах, протолитическое равновесие,
Дата добавления: 2015-04-29; просмотров: 2939;
