Теория слабых электролитов
Диссоциация любой частицы, являющейся слабым электролитом является обратимым процессом. Как и для любого другого обратимого процесса можно ввести понятие о константе равновесия, которая в данном случае получила название “константа диссоциации” (Кd). Например, угольная кислота является слабым электролитом и диссоциирует в две ступени (по второй ступени диссоциируют уже не молекулы Н2СО3, а гидрокарбонат-анионы НСО 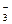 ):
):
1 cтупень: Н2СО3  Н+ + НСО
Н+ + НСО 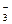
К 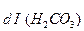 =
= 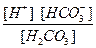
II ступень: HCO 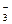
 H+ + CO
H+ + CO 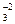
K 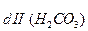 = Kd
= Kd 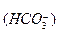 =
= 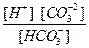
Общее уравнение: H2CO3  2H+ + CO
2H+ + CO 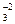
K  (общ) =
(общ) = 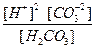
Нетрудно доказать, что
К 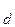 (общ) = К
(общ) = К 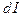 ×K
×K 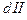 или К
или К 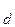 (общ) = К
(общ) = К 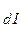 ×K
×K 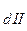 ×K
×K 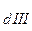 ×K
×K 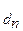 , где n - количество ступеней диссоциации слабого электролита.
, где n - количество ступеней диссоциации слабого электролита.
Используя принцип Ле-Шателье можно полагать, что К 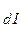 >> К
>> К 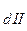 >> K
>> K 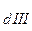 и т.д. И действительно, для всех слабых электролитов найдено, что константы диссоциации по (n - 1) - ой ступени на несколько порядков больше, чем таковая для n - ой ступени. Например, для угольной кислоты К
и т.д. И действительно, для всех слабых электролитов найдено, что константы диссоциации по (n - 1) - ой ступени на несколько порядков больше, чем таковая для n - ой ступени. Например, для угольной кислоты К 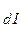 = 4,5 × 10-7, K
= 4,5 × 10-7, K 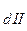 = 4,7 × 10-11.
= 4,7 × 10-11.
Величина константы диссоциации зависит только от природы элктролита и растворителя, а также от температуры. Значения К 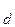 для различных веществ при определенной температуре (как правило, 25 °С) приведены в специальных справочных таблицах.
для различных веществ при определенной температуре (как правило, 25 °С) приведены в специальных справочных таблицах.
Константа диссоциации не зависит от концентрации электролита в растворе, а степень диссоциации (a) слабого электролита имеет явную зависимость от этого параметра: чем больше концентрация, тем меньше (a). Функционально эта зависимость описывается законом разбавления Оствальда:
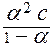 = K
= K 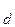 ,
,
где с - общая концентрация частиц электролита в растворе (моль/ дм3);
K 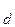 - константа диссоциации при данной температуре;
- константа диссоциации при данной температуре;
a - cтепень диссоциации.
В данном выражении независимой переменной является концентрация (С), а искомой величиной - a . Для решения этого уравнения его нужно преобразовать и решать относительно a как обычное квадратное уравнение:
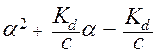 = 0.
= 0.
Положительным корнем этого уравнения является:
 a =
a = 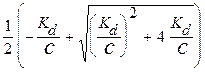 .
.
При решении многих задач предполагается, что a << 1 (a ® 0):

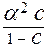 =
= 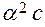 .
.
Поэтому во многих случаях можно использовать упрощенную формулу:
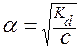 .
.
Она дает достаточно верный результат для значений a £ 0,1 . Если же получается a > 0,1 , то переходят к расчету по квадратному уравнению.
Дата добавления: 2015-04-29; просмотров: 1271;
