Тема 6. Растворы электролитов
Было установлено, что многие вещества, при растворении в полярных растворителях (например, в воде) распадаются на ионы. Такие вещества называются электролитами, а процесс распада на ионы называется электролитической диссоциацией (ЭД).
Электролитическая диссоциация является следствием взаимодействия вещества с молекулами растворителя. В ходе этого процесса образуются ионы, окруженные молекулами растворителя - так называемой сольватной оболочкой (если растворителем является вода, оболочка называется гидратной). Ион вместе с сольватной оболочкой называется сольватированным (в случае воды - гидратированным или акватированным).

Индекс (aq) означает, что данный ион акватирован. Очень часто этот индекс опускается.
Основной количественной характеристикой процесса ЭД является степень электролитической диссоциации (точнее: истинная степень ЭД). Степень электролитической диссоциации (a) - это отношение числа молекул данного вещества, распавшихся на ионы (np) к общему числу молекул в данном растворе (n0):
a = 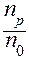 .
.
В соответствии со значениями a все вещества по отношению к данному растворителю можно разделить на 3 типа:
a = 0 неэлектролиты,
0 < a < 1 cлабые электролиты,
a = 1 cильные электролиты.
Сильные электролиты (уравнения диссоциации)
По современным представлениям, диссоциация сильного электролита является необратимым процессом (a = 1). В растворе сильного электролита нет его молекул, а есть только ионы, на которые он продиссоциировал. К сильным электролитам относятся:
1. Все соли. Соль диссоциирует как сильный электролит на кислотные остатки и основные остатки:
Fe2(SO4)3 = 2 Fe+3 + 3 SO 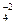 ,
,
NaHCO3 = Na+ + HCO 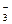 ,
,
AlOHCl2 = AlOH+2 + 2 Cl- .
2. Некоторые основания (они называются сильными основаниями или щелочами):
NaOH = Na+ + OH- ,
Ba(OH)2 = Ba+2 + 2OH- .
3. Некоторые кислоты (они называются сильными кислотами):
HCl = H+ + Cl- ,
HMnO4 = H+ + MnO 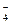 ,
,
H2SO4 = H+ + HSO 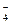 .
.
Слабые электролиты (уравнения диссоциации)
В отличие от сильных электролитов, слабые электролиты подвергаются ЭД обратимо. В растворе слабого электролита кроме ионов всегда присутствуют недиссоциированные молекулы. Причем, если раствор не слишком сильно разбавлен, целых молекул слабого электролита в нем, как правило, значительно больше, чем ионов.
К слабым электролитам относятся:
1. Многие кислоты (они называются слабыми) и все гидроанионы:
H2CO3  H+ + HCO
H+ + HCO 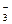 ,
,
HCO 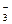
 H+ + CO
H+ + CO 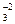 ,
,
CH3COOH  CH3COO- + H+ ,
CH3COO- + H+ ,
HSO 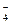
 H+ + SO
H+ + SO 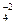 .
.
2. Многие основания (они называются слабыми) и все гидроксокатионы:
Fe(OH)2  FeOH+ + OH- ,
FeOH+ + OH- ,
FeOH+  Fe+ + OH- ,
Fe+ + OH- ,
NH4OH  NH
NH 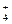 + OH- .
+ OH- .
3. Все амфотерные гидроксиды, их гидроанионы и гидроксокатионы:
Zn(OH)2  ZnOH+ + OH- ,
ZnOH+ + OH- ,
ZnOH+  Zn+2 + OH- ,
Zn+2 + OH- ,
H2ZnO2  H+ + HZnO
H+ + HZnO 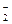 ,
,
HZnO 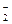
 H+ + ZnO
H+ + ZnO 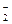 .
.
Дата добавления: 2015-04-29; просмотров: 2136;
