Давление насыщенного пара над мениском. Растворы. Осмос. Осмотическое давление. Закон Вант-Гоффа.
Испарение жидкости происходит с ее поверхности, поэтому изменение свойств поверхностного слоя должно изменять условие равновесия между жидкостью и паром над ней. В частности на условие равновесия и, следовательно, на давление насыщенного пара должна влиять кривизна поверхности жидкости.
При горизонтальной поверхности равновесие жидкости и насыщенного пара определяется только давлением насыщенного пара. Равновесие определяется силами, действующими на молекулу пара со стороны молекул жидкости. Величина этих сил зависит только от расстояния между молекулой пара и поверхностью жидкости (рис.1):

Рис.1. Силы, действующие на молекулу пара
Если поверхность жидкости вогнутая, то на молекулу, находящуюся на том же расстоянии над жидкостью будет действовать другая сила притяжения, потому что боковые поверхности жидкости находятся ближе к молекуле, чем в случае плоской поверхности. Равнодействующая молекулярных сил будет больше и она сильнее затягивает молекулу в жидкость, чем в случае плоской поверхности. Поэтому состояние динамического равновесия будет наблюдаться при меньшем давлении насыщенного пара, чем в случае плоской поверхности.
Если поверхность выпуклая, то силы, действующие на молекулу меньше, чем в случае плоской и вогнутой поверхности. Боковые части жидкости находятся на большем расстоянии от молекулы и действуют на нее слабее. Поэтому динамическое равновесие будет наблюдаться при большем давлении насыщенного пара, чем в случае плоской и вогнутой поверхностей.
Определим давление насыщенного пара над искривленной поверхностью жидкости. Пусть в закрытом сосуде с жидкостью находится капилляр, погруженный в жидкость. Жидкость смачивает капилляр (рис.2):
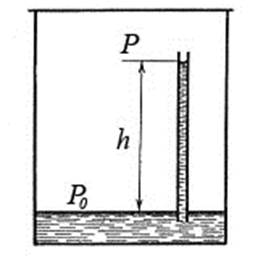
Рис.2. К выводу зависимости давления насыщенного пара от кривизны поверхности жидкости
С течением времени установится динамическое равновесие. Насыщенный пар будет находиться как над плоской поверхностью жидкости в сосуде, так и над вогнутой поверхностью жидкости в капилляре. Однако давление насыщенного пара изменяется с высотой согласно барометрической формуле:
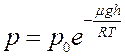 (1)
(1)
Согласно (1) давление насыщенного пара p на высоте h над вогнутой поверхностью жидкости в капилляре будет меньше, чем давление p0 над плоской поверхностью жидкости в сосуде. Если жидкость не смачивает капилляр, то она опускается ниже уровня жидкости в сосуде на высоту h и давление над выпуклой поверхностью жидкости в капилляре будет больше чем p0.
Определим изменение давления. Из рис.2 и формулы (1):
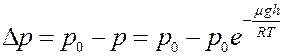 (2)
(2)
Или:
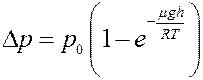 (3)
(3)
Разложим экспоненту в ряд, ограничившись двумя первыми членами:
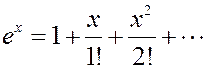
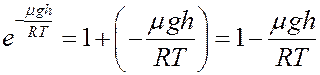 (4)
(4)
С учетом (4) перепишем (3) в виде:
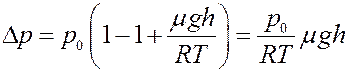 (5)
(5)
Из уравнения Клапейрона-Менделеева:
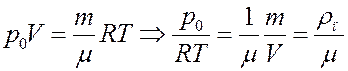 (6)
(6)
где m/V = ρп – плотность насыщенного пара.
Учитывая (6) из (5) получим:
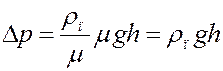 (7)
(7)
Известно, что высота поднятия жидкости в капилляре определяется формулой:
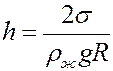 (8)
(8)
где R – радиус мениска, ρж – плотность жидкости. С учетом (8) из (7) получим:
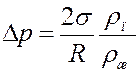 (9)
(9)
Определим давление p из (2) и (9):
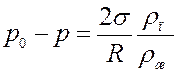
Или:
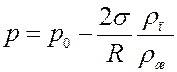 (10)
(10)
При несмачивании, когда поверхность жидкости выпуклая:
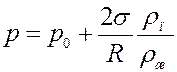 (11)
(11)
Из (10) и (11) следует, что давление насыщенного пара над вогнутой поверхностью жидкости меньше, а над выпуклой поверхностью больше, чем давление насыщенного пара над плоской поверхностью жидкости.
Величина давления при T = const, а, значит и плотность насыщенного пара над искривленной поверхностью жидкости зависит только от радиуса кривизны поверхности. Уравнения (10) и (11) справедливы для любой искривленной поверхности, как для капель жидкости – выпуклая поверхность, так и для пузырьков газа в жидкости – вогнутая поверхность.
Согласно (11) капли с разными радиусами не могут существовать в равновесии. Маленькие капли будут интенсивно испаряться (давление насыщенного пара больше), а на больших каплях жидкость будет конденсироваться (давление насыщенного пара меньше). Этот процесс будет продолжаться до тех пор, пока маленькие капли не исчезнут.
Аналогичные процессы происходят в облаках, где увеличение капель на центрах конденсации приводит к выпадению осадков.
Растворами называются физически однородные (гомогенные) смеси двух или нескольких веществ. Физическая однородность достигается равномерным перемешиванием молекул. Если одного вещества в растворе больше чем других оно называется растворителем. Подобно смеси газов раствор является однофазной системой.
В данной массе растворителя, при данной температуре может раствориться только определенное количество некоторого вещества. Полученный при этом раствор называется насыщенным, а максимальное количество растворенного вещества в единице объема растворителя называется растворимостью. Обычно растворимость увеличивается с повышением температуры, однако для некоторых веществ растворимость уменьшается с ростом температуры. Растворимость также зависит от свойств растворителя. Вода очень хороший растворитель, потому что молекулы воды полярные.
Растворы бывают слабые (разбавленные) – если число молекул растворенного вещества мало по сравнению с числом молекул растворителя. Растворы бывают крепкими. Очень крепкие растворы называются концентрированными. Самые простые растворы - бинарные – состоят из двух веществ: растворителя и растворенного вещества.
Относительное количество растворенного вещества характеризуется концентрацией раствора. Различают весовую, молярную и объемную концентрации.
Растворение обычно происходит с выделением или поглощением теплоты. В результате растворения молекулы растворенного вещества разделяются и сближаются с молекулами растворителя. Разделение молекул требует затрат энергии, а при сближении молекул энергия выделяется. Только в случае, когда энергия, необходимая для разделения молекул, равна энергии, выделившейся при сближении молекул тепловой эффект при растворении равен нулю.
Растворы с нулевым тепловым эффектом называются идеальными.
Количество теплоты, выделяющейся или поглощающейся при растворении 1 моля вещества, называется теплотой растворения.
Если теплота выделяется, то тепловой эффект положительный, если поглощается – отрицательный.
Например: нашатырь (NH4Cl) - -16,5 кДж/моль, едкий калий (KOH) - +54,2 кДж/моль. При смешивании поваренной соли со снегом или со льдом можно получить температуру до -21оC.
В единице объема раствора находится меньше молекул растворителя, чем в чистом растворителе. Следовательно, давление насыщенного пара над раствором должно быть меньше, чем над чистым растворителем. Рауль показал, что для слабых растворов справедливо соотношение:
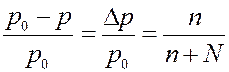 (12)
(12)
где p0 – давление насыщенного пара чистого растворителя, p - давление насыщенного пара раствора, n – число молекул (молей) растворенного вещества, N – число молекул (молей) растворителя. Для слабых растворов n << N, тогда (12) можно переписать в виде:
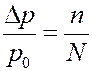 (13)
(13)
Относительное понижение давления насыщенного пара над раствором пропорционально концентрации раствора (n/N).
Если над раствором давление насыщенного пара уменьшается, то должна увеличиваться температура кипения раствора.
Согласно второму закону Рауля повышение температуры кипения раствора пропорционально концентрации растворенного вещества:
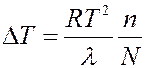 (14)
(14)
где ∆T – увеличение температуры кипения, λ – молярная теплота парообразования при температуре T, n/N – молярная концентрация раствора.
Рассмотрим слабые растворы. В таких растворах молекулы растворенного вещества находятся далеко друг от друга и слабо взаимодействуют между собой. В таких условиях молекулы растворенного вещества ведут себя подобно молекулам идеального газа.
Если привести в контакт чистый растворитель и раствор, то молекулы растворенного вещества будут переходить из раствора в растворитель. Этот процесс диффузии закончится только тогда, когда растворенное вещество равномерно распределится по всему объему растворителя. Таким же образом ведет себя и идеальный газ: расширяясь, он, занимает весь доступный ему объем. Подобно тому, как газ оказывает давление на стенки сосуда, молекулы растворенного вещества также должны оказывать давление на стенки сосуда. Они будут создавать парциальное давление в растворе.
Существуют вещества, тонкие слои которых пропускают сквозь себя растворитель, не пропуская при этом молекулы растворенного вещества. Такие пленки (мембраны) называются полупроницаемыми. К ним относятся оболочки из разных растительных и животных тканей. Подобные мембраны получают и искусственно, например, железосинеродистая медь – Cu2Fe(CN)6.
Если раствор отделить от растворителя такой мембраной, то молекулы растворителя будут переходить через мембрану в раствор, уменьшая его концентрацию.
Это явление называется осмосом. Осмос будет также наблюдаться, если мембрана разделяет два раствора разной концентрации. В результате осмоса возникает разность давлений между раствором и чистым растворителем. Когда разность давлений достигает определенной величины, осмос прекращается.
Концентрация молекул в чистом растворителе больше их концентрации в растворе на величину концентрации растворенного вещества. Поэтому сначала через мембрану диффундирует больше молекул растворителя в раствор, чем в обратном направлении. Состояние равновесия достигается, когда число молекул растворителя проходящих через мембрану в одном направлении будет равно числу молекул, проходящих через мембрану в противоположном направлении. Это значит, что концентрации растворителя по обе стороны от мембраны станут равными. В результате, при равновесии давление молекул растворителя на мембрану с разных сторон компенсируется. Однако столкновения молекул растворенного вещества о мембрану с одной стороны не компенсировано.
Если сосуд A с раствором, дно которого затянуто полупроницаемой перегородкой, поместить в сосуд B с чистым растворителем то уровень раствора в тонкой трубке C сосуда A будет повышаться в результате осмоса (рис.3).
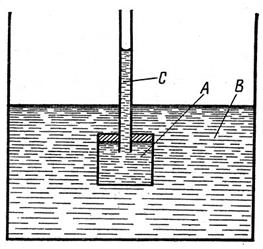
Рис.3. Установка для наблюдения осмоса
Когда уровень раствора в трубке C достигнет некоторой высоты, осмос прекращается. Очевидно, что гидростатическое давление этого столба раствора уравновешивает осмотическое или парциальное давление растворенного вещества (равно ему).
В слабых растворах молекулы растворенного вещества ведут себя подобно молекулам идеального газа. Поэтому осмотическое давление должно подчиняться уравнению Клапейрона-Менделеева:
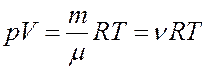 (15)
(15)
Из (15):
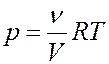 (16)
(16)
где m – масса растворенного вещества, μ – его молярная масса, V – объем раствора, ν – число молей растворенного вещества.
Однако:
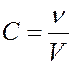 (17)
(17)
где C – молярная концентрация раствора (число молей растворенного вещества в единице объема раствора).
С учетом (17) из (16) получим величину осмотического давления:
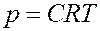 (18)
(18)
Этот закон установлен Вант-Гоффом в 1887 году и носит его имя.
Из закона Вант-Гоффа следует:
1. Для данного растворенного вещества осмотическое давление при T = const пропорционально концентрации раствора;
2. Для данного растворенного вещества при постоянной концентрации осмотическое давление пропорционально абсолютной температуре раствора;
3. Для разных растворенных веществ при одинаковой температуре и весовой концентрации (m/V) раствора осмотическое давление обратно пропорционально молярной массе растворенного вещества.
Для большого числа слабых растворов закон Вант-Гоффа хорошо выполняется. Однако для ряда веществ (неорганические соли, кислоты, щелочи) осмотическое давление получается значительно больше вычисленного по формуле Вант-Гоффа. Это объясняется диссоциацией (распадом) молекул этих веществ на ионы при растворении. В результате этого число частиц в единице объема раствора возрастает, что приводит к увеличению осмотического давления.
Осмотическое давление играет важную роль в жизнедеятельности организмов и растений. Обмен веществ в них осуществляется с помощью крови, соков – растворов, которые омывают мембраны клеток. Распределение воды и растворенных в ней веществ в значительной степени определяется осмотическим давлением.
Дата добавления: 2015-05-21; просмотров: 2615;
