Восстановление металлов из оксидов и солей
В основе данного метода, охватывающего широкий круг реакций, лежит восстановление выбранного металла каким-либо восстановителем в газообразной или жидкой фазе. Реакции в твердой фазе не получили широкого распространения вследствие трудностей, возникающих при разделении продуктов реакции и непрореагировавших исходных веществ.
Восстановителями могут быть вещества в различных агрегатных состояниях, в том числе и твердом состоянии. В последнем случае крайне желательно, чтобы продукты реакции находились в другом агрегатном состоянии (жидком или газообразном). Применение восстановителей в различных агрегатных состояниях приводит и к различию в кинетических характеристиках системы, что, безусловно, следует учитывать при проведении синтеза.
Чаще всего металлы получают из их оксидов или сульфидов, поскольку, с одной стороны, многие руды представляют собой либо оксиды, либо сульфиды металлов, и, с другой стороны, термодинамика и кинетика подобных реакций достаточно хорошо изучены.
 Как уже неоднократно упоминалось, возможность протекания реакции восстановления зависит от соотношения изобарно-изотермичеоких потенциалов конечных и начальных продуктов реакции. Чем больше их разница, тем вероятнее протекание реакции. Зависимость
Как уже неоднократно упоминалось, возможность протекания реакции восстановления зависит от соотношения изобарно-изотермичеоких потенциалов конечных и начальных продуктов реакции. Чем больше их разница, тем вероятнее протекание реакции. Зависимость 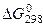 для некоторых оксидов от температуры представлена на рисунке.
для некоторых оксидов от температуры представлена на рисунке.
Из рисунка видно, что чем ниже линии 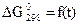 , тем устойчивее оксид и тем сильнее восстановительная способность свободного металла.
, тем устойчивее оксид и тем сильнее восстановительная способность свободного металла.
Для сравнения на рисунка приведена зависимость ∆G0 от температуры для реакции 2Н2+О2=2Н2О (пунктирная линия). Из рисунка видно, что наиболее активным восстановителем является кальцин, водород же способен восстанавливать далеко не все металлы из их оксидов.
В табл. 5 приведены справочные данные о стандартных изобарно-изотермических потенциалах ( 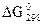 ) образования некоторых оксидов, сульфидов и галогенидов.
) образования некоторых оксидов, сульфидов и галогенидов.
Чаще других для непосредственного восстановления металлов из их оксидов применяется один из достаточно сильных восстановителей – алюминий. Металлотермические реакции довольно подробно описаны в литературе, поэтому останавливаться на условиях их протекания нет большой необходимости. Однако следует заметить, что синтезировать достаточно чистые металлы таким путем, как правило, не удается. Дальнейшая очистка требует существенных затрат времени и энергии, что приводит к нерентабельности применения данного метода для получения чистых металлов. Металлотермию, по-видимому, следует применять только в тех случаях, когда другие методы не в состоянии обеспечить получения металла или когда чистота металла не играет существенной роли.
Более выгодно применение восстановителей, находящихся в другом агрегатном состоянии, в частности в газообразном, ибо продукты окисления, появляющиеся в результате проведения восстановления металла из оксидов, легко удаляются из зоны реакции, смещая равновесие в сторону получения металла.
Как уже упоминалось, возможно, применение восстановителей и в твердом состоянии в том случае, если продукты реакции получаются в газообразном или жидком состоянии.
При проведении синтезов в подобных системах необходимо обращать особое внимание на кинетику удаления продуктов реакции из твердой фазы, применяя соответствующие условия синтеза.
Естественно, что процесс восстановления возможен только в тех случаях, которые разрешены термодинамикой. Проводя восстановление подобного вида, нужно помнить, что с уменьшением степени окисления металла в оксиде прочность связи металл-кислород возрастает, в результате чего могут воз никнуть условия, при которых восстановление, Например, водородом, остановится на какой-либо ступени окисления металла, к.е. образуется не свободный металл, а оксид в более низком состоянии окисления металла.
Таблица 5
Дата добавления: 2015-06-17; просмотров: 2592;
