Стандартные изобарно-изотермические потенциалы ( ) (кДж/моль) образования некоторых оксидов, галогенидов и сульфидов.
| Вещество | 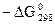
| Вещество | 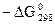
| Вещество | 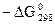
| |||
| Оксиды | Оксиды | Галогениды | ||||||
| Ag2O A12O3 As2O3 As2O5 BaO BaO2 BeO B2O3 Bi2O3 CaO Ce2O3 CeO2 CdO CoO Co3O4 Cr2Os CrO3 Cu2O CuO Fe2O3 GeO GeO2 HgO HfO2 In2O3 La2O3 Li2O MgO MnO Mn2O3 MnO2 Mn2O7 MoO2 | 10,5 1583,8 569,8 773,0 511,2 584,5 579,0 1195,0 494,4 605,0 1709,5 1026,6 228,8 215,4 765,2 1060,9 505,7 148,3 128,2 743,3 209,9 502,8 58,7 1154,6 831,7 1707,8 562,7 570,3 363,3 882,6 465,9 544,7 536,0 | MoO3 Na2O Nb2O3 Nb2O5 Nb2O4 NiO PbO PbO2 Rb2O Re2O7 SnO SnO2 Sb2O3 Sb2O5 SeO2 SeO3 SiO2 SrO Ta205 TeO2 TiO2 VO V203 VO2 V2O3 UO2 WO2 WO3 ZnO ZrO2 | 668,7 379,6 1772,4 1766,5 1516,8 212,0 189,0 217,9 293,3 1050,4 257,3 520,8 636,9 866,1 171,8 84,2 857,7 574,9 1915,2 264,8 890,4 404,8 1150,5 1320,3 1428,8 1033,7 534,6 765,1 321,4 1044,56 | AgBr AgCl AgF AgI AlF3 A1C13 A1I3 AuF AuCl AuF3 AuCl BaF2 BaCl2 BeF2 BeCl2 CaF2 CaCl2 CaI2 CdF2 CdCl2 CdBr2 CdI2 CrCl2 CrI2 CrCl3 CeCl3 CoCl2 CuF CuCl CuBr CuI CuCl2 CuF2 | 97,6 109,8 186,5 66,2 1433,0 629,8 314,3 58,7 19,7 297,5 49,0 1139,7 798,6 988,8 446,2 1177,8 750,4 529,6 652,0 344,8 297,5 204,0 357,0 230.0 446,6 985,5 270,2 230,5 119,4 102,2 71,2 172,2 492,7 | |||
| Галогениды | Галогениды | Сульфиды | ||||||
| MoI2 NiF2 NiCl2 NaF NaCl NaBr NaI PbF2 PbCl2 PbBr2 PbI2 PbCl4 RbCl RbI SrF2 SrBr2 SbCl3 SeCl4 ThF4 ThCl4 TiCl2 TiCl3 TiI4 TiBr4 TiCl4 | 54,5 611,3 259,4 547,2 385,1 349,5 285,8 628,5 314,6 262,3 176,4 356,0 408,1 329,3 1182,4 709,4 324,3 859,0 2004,5 1106,2 469,7 665,8 381,3 590,8 754,0 | TlCl TlI TlCl3 VCl2 VC13 UF4 WI2 ZnF2 ZnCl2 ZnBr2 ZnI2 ZrF4 ZrCl4 | 185,2 125,3 293,3 397,6 515,0 1836,5 10,5 714,4 571,1 313,0 212,0 1812,6 976,3 | Ag2S Bi2S3 CdS CoS CoS2 Co2S4 CuS Cu2S FeS FeS2 Fe2S2 GeS GeS2 HgS MnS MnS2 MoS2 NiS Ni2S3 PbS Sb2S3 SnS T12S3 WS2 ZnS | 40,6 153,4 140,8 84,6 137,4 323,9 53,6 86,3 100,6 163,0 281,1 70,0 187,7 49,0 218,3 232,5 226,3 79,6 197,3 98,9 156,3 98,5 93,9 204,1 198,6 | |||
Восстановление галогенидов (кроме фторидов) или сульфитов водородом протекает обычно с большим трудом, чем восстановление оксидов, так как изменение изобарно-изотермического потенциала при образовании галогеноводородов или сероводорода гораздо менее благоприятно, нежели при образовании воды, в чем можно убедиться, проанализировав нижеприведенные данные.
| Соединение | H20 | H2S | HF | HCl | HBr | HI |
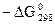
| 228.8 | 33.5 | 270.3 | 95.3 | 53.6 | –1.3 |
Кроме того, применение галогенидов в качестве восстанавливающихся объектов не имеет каких-либо преимуществ по сравнению с оксидами, ибо безводные галогениды получаются газ оксидов (особенно тугоплавких), как правило, с большим трудом. Использовать галогениды, вероятно, целесообразно только тогда, когда образование низшего оксида затрудняет полное восстановление. Так, например, V2O4 восстанавливается водородом только до VO и то при высоких температурах (~1700°С). Получение же металла если и возможно, то при еще больших температурах и повышенном давлении. В то же время VCl3 или VC14 восстанавливается водородом до металла. С помощью восстановления водородом можно получить достаточно чистые металлы, так как сам водород легко получается в чистом состоянии; при этом водород не образует мешающих побочных продуктов и без труда может быть удален откачиванием при нагревании.
Иногда вместо водорода используют оксид углерода или аммиак. Восстановление с помощью оксида углерода (II) начинается часто при более низкой температуре, чем с помощью водорода (оксид железа восстанавливается угарным газом при температуре меньшей 240°С). Однако в большинстве случаев образующийся металл катализирует побочную реакцию 2СО  С + СО2, что приводит к неизбежному выделению углерода и загрязнению металла, если процесс проводить при температуре не ниже 1000°С. Лишь немногие металлы не оказывают каталитического действия на реакцию диспропорционирования оксида углерода, например, серебро, медь, свинец, сурьма и висмут.
С + СО2, что приводит к неизбежному выделению углерода и загрязнению металла, если процесс проводить при температуре не ниже 1000°С. Лишь немногие металлы не оказывают каталитического действия на реакцию диспропорционирования оксида углерода, например, серебро, медь, свинец, сурьма и висмут.
Применение аммиака в качестве восстановителя ограничено системами, в которых исключается образование устойчивых нитридов (системы с кобальтом, никелем, висмутом).
До сих пор мы рассматривали реакции, протекающие в отсутствие растворителя. Однако восстановление металлов из их солей может осуществляться и путем применения так называемых гидрометаллургических (или сольвометаллургических, если реакция идет не в водном растворе) процессов. В основе подобного вида синтезов металлов лежит ряд напряжения металлов и, в частности, общеизвестное следствие из него, говорящее о возможности вытеснения каждым предыдущим металлом этого ряда любого последующего металла из его соли. При проведении реакций восстановления в водных растворах (особенно подкисленных) нужно помнить, что в присутствии металлов сильных восстановителей ионы гидроксония восстанавливаются до водорода. Протекание окислительно-восстановительной реакции, как известно, зависит не только от активности самого восстановителя (металла или его амальгамы), но также от активности связанного иона. В качестве металлов-восстановителей в водном растворе прежде всего имеют значение цинк, кадмий, алюминий и магний, а также амальгамы щелочных и щелочноземельных металлов. Названные металлы образуют в большинстве случаев легкорастворимые соли, редко мешающие выделению и дальнейшей очистке восстановленного металла. Вследствие легкой восстанавливаемости иона водорода такие сильные восстановители, как натрий, калий или кальций в водном и даже спиртовом растворе почти не применимы. Однако жидкий аммиак растворяет эти металлы без изменения степени окисления и в отсутствие катализатора реагирует с ними лишь крайне медленно с выделением водорода. Восстановление в этих условиях в большинстве случаев протекает настолько гладко, что избыток восстановителя не требуется. Реакционная способность калия и натрия, растворенных в жидком аммиаке, примерно одинакова; раствор кальция по сравнению с ними во многих случаях оказывается более реакционноспособным. Взаимодействие калия с галогенидами металлов в жидком аммиаке чаще всего ведет к образованию свободного металла, который выделяется в очень тонко измельченной форме или образует с избытком восстановителя интерметаллическое соединение. Часто выделившиеся металлы (никель, железо, марганец, серебро) катализируют разложение избыточного восстановителя на щелочной амид и водород.
Вытеснение менее активных металлов металлами более активными осуществляется и в средах, содержащих алкилы металлов. Например, диметилртуть Hg(CH3)2 реагирует с литием, натрием, магнием или алюминием с выделением металлической ртути и образованием алкилов соответствующих металлов.
Из рассмотрения окислительно-восстановительных потенциалов многих систем можно заключить, что лишь небольшая часть восстановителей-неметаллов может быть пригодна для восстановления некоторых металлов из растворов их солей. Нужно заметить, что такие окислительно-восстановительные системы во многих случаях необратимы и непосредственно измеряемые потенциалы не всегда совпадают с рассчитанными по термодинамических данных. Метастабильный характер участвующих в реакции ионов и связанное с этим замедление реакции часто устраняют катализаторами, например тонкоизмельченным палладием.
Таблица 6
Дата добавления: 2015-06-17; просмотров: 1930;
